【7章】元素の地図「周期表」をマスターしよう
最終更新日: 2026-01-14 10:49:39
作成者: カリスマ講師
ここから「無機物質」の学習に入ります。無機化学は「暗記が多い」と思われがちですが、実は**「周期表」という地図の読み方**さえわかれば、元素の性質を丸暗記せずに予測できるようになります。
まずは、この地図がどうやってできたのか、そしてどう読むのかを整理しましょう。
1. 周期表はこうして生まれた(歴史)
バラバラに見える元素に「ある法則」があることを発見した科学者たちの歴史が描かれています。
メンデレーエフの発見
昔の科学者たちは、似た性質の元素があることには気づいていましたが、それをうまく整理できませんでした。
そこで登場したのが、ロシアのメンデレーエフ(1869年)です。
- 何をした?
- 当時の元素を**「原子量の小さい順(重さ順)」**に並べてみました。
- すると、性質のよく似た元素が「定期的なリズム」で現れることに気づいたのです。
- これを**「周期律(しゅうきりつ)」**と呼びます。
現在の周期表との違い
メンデレーエフは偉大でしたが、実は少しだけ例外がありました。その後、研究が進み、現在の周期表は以下のように改良されています。
- 昔: 原子量(重さ)の順
- 今: 原子番号(陽子の数)の順
ここがポイント!
「原子番号順」に並べることで、化学的な性質のズレがなくなり、現在の完璧な表が完成しました。
2. 「周期律」ってどういうこと?
「性質が周期的に現れる」と言われてもピンとこないかもしれません。グラフ(図2)を見てみましょう。
- グラフの意味: 横軸に原子番号、縦軸に融点(溶ける温度)をとっています。
- 波の形: 山があり、谷があり、また山が来る……という波のような形を繰り返していますね。
- 結論: 融点だけでなく、原子の大きさやイオン化エネルギーなど、あらゆる性質が**「ある間隔をおいて似たような変化を繰り返す」**のです。これが周期律です。
3. 周期表の読み方(族と周期)
周期表(図3)は、ただの表ではありません。**「縦」と「横」**に深い意味があります。
①「族(ぞく)」= 縦の列
- 縦の列(1~18列)を**「族」**と呼びます。
- 超重要ルール: 同じ族(縦の並び)の元素は、性質がめっちゃ似ている!
- これを**「同族元素」**と呼びます。
- (例)1族の元素たちは、どれも水と激しく反応する、など「家族」のように似ています。
②「周期(しゅうき)」= 横の行
- 横の行(1~7行)を**「周期」**と呼びます。
- 原子番号が増えるにつれて、電子の殻(K殻、L殻…)が外側に増えていくイメージです。
③ 特別に名前がついている「家族」
同族元素の中でも、特にキャラが濃い(特徴的な)グループには名前がついています。これは必ず覚えましょう。
| 族 | グループ名 | 特徴のイメージ | 該当元素の例 |
| 1族 | アルカリ金属 | 水と激しく反応する暴れん坊(Hは除く) | Li, Na, K... |
| 2族 | アルカリ土類金属 | アルカリ金属に次いで元気(Be, Mgは除く) | Ca, Sr, Ba... |
| 17族 | ハロゲン | 毒性があり、反応性が高い | F, Cl, Br, I... |
| 18族 | 希ガス | 全く反応しない、平和主義者(安定している) | He, Ne, Ar... |
4. 元素の2つの分類方法
周期表の元素は、性質によって大きく2通りの分け方ができます。
分類A:並び方のルールで分ける
電子の増え方や性質の変化の仕方による分類です。
- 典型元素(てんけいげんそ)
- 場所: 周期表の両端(1, 2族 と 12~18族)。
- 特徴: 「族(縦)」が同じなら性質が似ている。「お隣さん(横)」とは性質が違う。
- イメージ: ルール通りの素直な優等生たち。
- 遷移元素(せんいげんそ)
- 場所: 周期表の真ん中の凹んだ部分(3~11族)。
- 特徴: 「お隣さん(横)」とも性質が似ている。
- イメージ: 似たもの同士が集まっている集団。すべて金属です。
分類B:電気や熱を通すかで分ける
- 金属元素
- 場所: 周期表の左側~中央(全体の約80%)。
- 特徴: 電気・熱をよく通す、光沢がある。
- 傾向: 左下に行くほど「金属らしさ(陽性)」が強くなります。
- 非金属元素
- 場所: 周期表の右上一角。
- 特徴: 電気をあまり通さない(気体や脆い固体が多い)。
- 傾向: 右上に行くほど「非金属らしさ(陰性)」が強くなります。
注意!「両性元素」
金属と非金属の境界線あたり(Al, Zn, Sn, Pbなど)には、どちらの性質も併せ持つ「両性元素」が存在します。これらは酸とも塩基とも反応するコウモリのような存在です。
ここまでのまとめ(第1部の復習)
- 周期表は原子番号順に並んでいる。
- **縦の列(族)**が同じなら、性質が似ている(同族元素)。
- **横の行(周期)**は電子の殻の数を表す。
- 元素は典型/遷移、金属/非金属というグループ分けができる。
性質が決まる理由と「第3周期」のドラマ
1. なぜ「同族元素」は性質が似ているのか?(p.221)
「族(縦の列)が同じなら性質が似ている」というお話をしましたが、その理由は**原子の中身(電子の並び方)**を見ると一発でわかります。
カギは「価電子(かでんし)」の数
原子は、中心の原子核の周りを「電子」が回っている構造をしています。電子は内側の殻(K殻、L殻…)から順に入っていきますが、化学反応において一番重要なのは、**「一番外側の殻にある電子(最外殻電子)」です。
これを「価電子(かでんし)」**と呼びます。
- 表1(p.221)を見てみましょう
- 1族(Li, Na, K...): 一番外側の電子はみんな**「1個」**です。
- 17族(F, Cl...): 一番外側の電子はみんな**「7個」**です。
結論:
化学反応とは、この一番外側の電子をあげたりもらったりすることです。
「一番外側の電子の数(価電子数)」が同じだから、反応の仕方がそっくりになるのです。
2. 第3周期の元素で見る「性質の移り変わり」(p.221〜222)
ここが今回のハイライトです。周期表の横の列、特に**「第3周期(Na, Mg, Al, Si, P, S, Cl)」**を左から右へ見ていくと、性質がグラデーションのようにきれいに変化します。
教科書の表2(p.222)は非常に重要なので、その中身をわかりやすく翻訳します。
① 「金属」から「非金属」への変化
左側はゴリゴリの金属ですが、右へ行くほど金属らしさが消えていきます。
- 左側(Na, Mg, Al): 金属元素。電気が流れ、陽イオンになりやすい(陽性)。
- 中央(Si): 半導体など、中間的な性質。
- 右側(P, S, Cl): 非金属元素。陰イオンになりやすい(陰性)。
② 水との反応性(元気の良さ)
左の金属ほど「電子を捨てたい!」という欲求が強く、水と激しく反応します。
- Na(1族): 冷水でも激しく反応して水素を出す!(危険)
- Mg(2族): 冷水はダメ。熱水なら反応する。
- Al(13族): 熱水でも反応しない。高温の水蒸気なら反応する。
- それ以降(Si〜): 水とは反応しにくい。
- ※ただし、Cl₂(塩素)などは別の仕組みで水に少し溶けて反応します。
③ 酸化物・水酸化物の性質(酸性・塩基性)
ここがテスト頻出ポイントです。「その元素の酸化物(酸素とくっついたもの)」が、酸性か塩基性かには明確なルールがあります。
絶対覚えるルール
- 金属の酸化物 = 塩基性 になる
- 非金属の酸化物 = 酸性 になる
このルールを第3周期に当てはめてみましょう。
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 分類 | 金属 | 金属 | 両性 | 非金属 | 非金属 | 非金属 | 非金属 |
| 酸化物の性質 | 強塩基性
(Na₂O) | 塩基性
(MgO) | 両性
(Al₂O₃) | 弱酸性
(SiO₂) | 酸性
(P₄O₁₀) | 強酸性
(SO₃) | 強酸性
(Cl₂O₇) |
- ポイント1: 左(金属)は塩基性、右(非金属)に行くほど酸性が強くなる。
- ポイント2(超重要): Al(アルミニウム)は「両性(りょうせい)」。
- 酸とも反応するし、塩基とも反応する「どっちつかず」な存在です。これを両性酸化物と呼びます。
3. 遷移元素ってなに?(p.222下)
最後に、周期表の真ん中にある「遷移元素(3〜11族)」について少しだけ触れています。
- 典型元素との違い
- 典型元素: 外側の殻に電子が増えていく → だから隣同士で性質が大きく変わる。
- 遷移元素: 外側の数は変わらず、**「内側の殻」**に電子が補充されていく特殊な増え方をする。
- 結果どうなる?
- 一番外側の電子(価電子)の数が**「1個か2個」**のままであることが多い。
- そのため、隣り合った元素同士(横の並び)でも性質が似ているのです。
全体のまとめ
教科書p.222の「まとめ」ボックスの内容を、さらに噛み砕いて整理します。
- 周期律の基本: 元素を原子番号順に並べると、性質が周期的に変化する。
- 分類:
- 典型元素(両端) vs 遷移元素(中央)
- 金属(左下) vs 非金属(右上)
- 第3周期のトレンド(左から右へ):
- 金属 → 非金属
- 塩基性酸化物 → 両性酸化物(Al) → 酸性酸化物
- この流れは**「金属は塩基、非金属は酸」**と覚えておけばOK!
水素と希ガス
ここでは、周期表の「一番最初の元素(水素)」と「一番右端の元素(希ガス)」という、対照的な2つのグループを学びます。
1. 水素(H₂):宇宙で一番軽い元素
水素($H_2$)は、すべての元素の中で最も軽く、燃えやすい気体です。まずは「どうやって作るか」が重要です。
① 水素の作り方(ここがテストに出る!)
水素を作る方法は、「工場で大量に作る場合」と「実験室で少し作る場合」で異なります。
A. 実験室での作り方(超重要)
教科書p.223の図5を見てください。この実験装置のイラストはテストの定番です。
- 材料: 亜鉛(Zn) + 希硫酸($H_2SO_4$)
- 反応式:
$$Zn + H_2SO_4 \longrightarrow ZnSO_4 + H_2$$ - なぜこの材料?
- 金属なら何でもいいわけではありません。金(Au)や銅(Cu)は酸に溶けず、逆にナトリウム(Na)などは爆発して危険です。ほどよく反応する**亜鉛(Zn)や鉄(Fe)**が使われます。
- 集め方: 水に溶けにくいので、水上置換法(水の中でブクブク集める方法)を使います。
B. 工業的な作り方(参考程度)
石油や天然ガスを高温で加熱したり、水を電気分解したりして大量生産します。
② 水素の性質:「燃える」と「奪う」
水素には、大きく2つの特徴的な「性格」があります。
性格1:とにかく燃える(爆発的)
- 水素に火をつけると、酸素と結びついて水になります。このとき大量の熱を出します。
$$2H_2 + O_2 \longrightarrow 2H_2O$$ - 注意点: 空気が混ざった状態で火をつけると大爆発(爆鳴気)を起こします。実験時は空気を抜くなど注意が必要です。
性格2:酸素を奪い取る「還元作用(かんげんさよう)」
- ここが重要: 水素は酸素とくっつきたがり屋です。そのため、すでに酸素とくっついている物質(酸化物)から、無理やり酸素を奪い取って水になろうとします。
- 例えば、酸化銅(CuO)に水素を通して加熱すると、銅(Cu)に戻ります。これを**「還元(かんげん)」**といいます。
$$CuO + H_2 \longrightarrow Cu + H_2O$$
(酸化銅の酸素 $O$ が、水素 $H_2$ に奪われて $H_2O$ になっています)。
2. 希ガス(18族):孤独を愛する安定な貴族
教科書p.224の下半分は、周期表の一番右側(18族)にある**「希ガス(きがす)」**の話です。
メンバーは、ヘリウム(He)、ネオン(Ne)、アルゴン(Ar)などです。
① なぜ「希(まれ)なガス」なのか?
英語では "Noble gas"(貴ガス=貴族のようなガス)とも呼ばれます。彼らの最大の特徴は、**「他の元素と全く反応しない」**ことです。
- 理由: 電子の配置が完璧だから。
- 一番外側の電子の殻がいっぱい(Heは2個、その他は8個)になっており、これ以上電子をもらう必要もあげる必要もありません。
- この状態を**「安定な電子配置」**といいます。
② 希ガスの特徴
- 単原子分子(たんげんしぶんし)
- 水素($H_2$)や酸素($O_2$)のように2人でペアを組まず、原子1個(He, Ne...)だけで気体として存在します。誰かとくっつく必要がないからです。
- 融点・沸点がめちゃくちゃ低い
- お互いに引き合う力が弱いため、すぐにバラバラになって気体になります。
③ 身近な用途
反応しない=「安全」という性質を利用しています。
- ヘリウム(He): 軽くて燃えないので、風船や飛行船に使われます(水素は燃えるので危険)。
- ネオン(Ne): 放電管に入れると特有の赤い光を出すので、ネオンサインに使われます。
- アルゴン(Ar): 反応しないので、蛍光灯の中や、金属溶接の際のガードガスとして使われます。
まとめ:ここだけは押さえよう!
- 水素の実験室での製法:
- 亜鉛(Zn) に 希硫酸($H_2SO_4$) を加える。
- 水素の還元作用:
- 酸化物から酸素を奪い取り、相手を裸(単体)にする力がある。
- 希ガス(18族):
- 電子配置が安定しているため、他の物質と反応しない。
- 単原子分子として存在する。
カラフルな暴れん坊「ハロゲン」
1. ハロゲン単体:4兄弟の「色」と「強さ」のルール(p.225)
周期表の17族(F, Cl, Br, I)を**「ハロゲン」**と呼びます。
彼らは「あと電子が1個あれば完璧になれる!」という状態なので、他から電子を奪い取ろうとする力が非常に強い(酸化力が強い)のが特徴です。
この4兄弟には、上から順にきれいなグラデーションのような法則があります。表4(p.225)の内容は以下の表で完璧に覚えましょう。
| 元素 | 記号 | 常温での状態 | 色(超重要!) | 反応の激しさ |
| フッ素 | $F_2$ | 気体 | 淡黄色(うすい黄色) | 最強(水とも爆発的に反応) |
| 塩素 | $Cl_2$ | 気体 | 黄緑色 | 強(水に少し溶ける) |
| 臭素 | $Br_2$ | 液体 | 赤褐色(暗い赤) | 中 |
| ヨウ素 | $I_2$ | 固体 | 黒紫色(黒っぽい紫) | 弱 |
ここがポイント!
- 状態の変化: 上から順に「気体 → 液体 → 固体」と重くなっていきます。
- 色の変化: 上から順に「薄い色 → 濃い色」になります。
- 反応性の強弱: 上が一番強く、下に行くほど弱くなります($F_2 > Cl_2 > Br_2 > I_2$)。
- 強いやつは、弱いやつから席(化合物の相手)を奪い取ります。
- 例:$2KI + Cl_2 \longrightarrow 2KCl + I_2$
- (強い塩素 $Cl$ がやってくると、弱いヨウ素 $I$ は追い出されて単体に戻ってしまう)
2. 主役:「塩素 ($Cl_2$)」をマスターする(p.226)
ハロゲンの中で最も出題されるのが塩素です。「作り方」と「性質」の両方が問われます。
① 塩素の作り方(実験室)
教科書p.226の図6の実験装置はテストの常連です。
- 材料: 酸化マンガン(IV) ($MnO_2$) + 濃塩酸 ($HCl$) を加熱。
- 反応式:
$$MnO_2 + 4HCl \longrightarrow MnCl_2 + 2H_2O + Cl_2$$ - 装置の工夫(洗気びん): 発生したガスには不純物が混ざっているので、2つのボトルを通してきれいにします。
- 水を通す → 余分な塩酸(HCl)を取り除く。
- 濃硫酸を通す → 水分($H_2O$)を取り除いて乾燥させる。
- 順番を逆にすると、せっかく乾燥させたのにまた湿ってしまうので注意!
② 塩素の性質
- 黄緑色で、プールの消毒液のような刺激臭があります。毒性あり。
- 漂白・殺菌作用:
- 水に少し溶けて、一部が**次亜塩素酸(HClO)**になります。これが汚れを落とす(酸化する)正体です。
$$Cl_2 + H_2O \rightleftharpoons HCl + HClO$$
3. その他のハロゲンの個性(p.227〜228)
フッ素 ($F_2$):危険すぎる暴れん坊
- 最強の酸化力を持ちます。
- 水と触れただけで、酸素を押しのけて激しく反応します(酸素が発生)。
$$2F_2 + 2H_2O \longrightarrow 4HF + O_2$$
臭素 ($Br_2$):レアな液体
- 常温で**「赤褐色の液体」**である非金属元素は、臭素だけです。
ヨウ素 ($I_2$):昇華とデンプン
- 昇華性: 黒紫色の固体ですが、温めると液体にならずにいきなり紫色の気体になります。
- ヨウ素デンプン反応: デンプン(お米やパンの成分)に出会うと青紫色になります。うがい薬(イソジンなど)の色です。
4. ハロゲン化合物:水素とのコンビ「HX」(p.229〜230)
ハロゲンと水素がくっついたものを「ハロゲン化水素(HX)」といいます。
ここでも**「フッ化水素(HF)だけ仲間はずれ」**というルールが重要です。
| 化合物 | 水溶液の名前 | 酸の強さ | 沸点 | 特徴 |
| HF (フッ化水素) | フッ化水素酸 | 弱酸 | 高い (19.5℃) | ガラスを溶かす! |
| HCl (塩化水素) | 塩酸 | 強酸 | 低い (-85℃) | アンモニアと白煙を作る |
| HBr | 臭化水素酸 | 強酸 | 低い | |
| HI | ヨウ化水素酸 | 強酸 | 低い |
なぜHF(フッ化水素)だけ特別なのか?
- 弱酸である: 水素とフッ素の結びつきが強すぎて、水の中であまり離れない(電離しない)からです。
- 沸点が高い: 分子同士が「水素結合」という特別な力で手をつなぐため、なかなか気体になりません。
- ガラスを溶かす: ガラスの主成分(二酸化ケイ素 $SiO_2$)と反応して溶かしてしまいます。そのため、ポリエチレン容器に入れて保存します(ガラス瓶はNG)。
5. 色で見分ける沈殿反応(p.230〜231)
最後に、「ハロゲンが含まれているか?」を調べる実験です。
銀イオン ($Ag^+$) を加えると、水に溶けない沈殿ができます。この沈殿の色がテストに出ます。
- AgCl(塩化銀): 白色
- AgBr(臭化銀): 淡黄色(うすい黄色)
- AgI(ヨウ化銀): 黄色
- ※AgF(フッ化銀)だけは水に溶けるので沈殿しません。
写真のフィルムの原理
これらの「ハロゲン化銀」に光が当たると、分解して銀 ($Ag$) が出てきて黒くなります。これを「感光性」といい、昔の写真フィルムに使われていました。
まとめ
- 色の順番言える? (淡黄→黄緑→赤褐→黒紫)
- 反応性の順番言える? ($F_2 > Cl_2 > Br_2 > I_2$)
- 塩素の作り方: 酸化マンガン(IV) + 濃塩酸。
- フッ化水素(HF)の例外: 弱酸、ガラスを溶かす、保存はポリエチレン容器。
- 銀との沈殿色: AgCl(白) → AgBr(淡黄) → AgI(黄)。
酸素と硫黄の「変身」
ここでは、私たちの呼吸に必要な「酸素」と、黄色い固体の「硫黄」について学びます。この単元のキーワードは**「同素体(どうそたい)」**です。
0. (前回のおさらい)さらし粉(p.232)
ハロゲンの最後に、生活で役立つ物質が一つ紹介されています。
- さらし粉($CaCl(ClO) \cdot H_2O$)
- 作り方: 消石灰(水酸化カルシウム)に、塩素ガスを吸わせて作ります。
$$Ca(OH)_2 + Cl_2 \longrightarrow CaCl(ClO) \cdot H_2O$$ - 用途: プールの消毒剤や漂白剤として使われます。水に溶かすと塩素のような殺菌作用(次亜塩素酸)を出します。
1. 酸素族元素とは?(p.233)
周期表の16族(O, S, Se, Te)を酸素族元素と呼びます。
これらは17族(ハロゲン)ほどではありませんが、電子を欲しがる(陰性が強い)性質を持っています。
2. 酸素($O_2$):生命の源(p.233, 234)
酸素は空気の約21%を占める気体です。テストで問われるのは「作り方」です。
① 酸素の作り方(実験室)
教科書p.233の図10、p.234の図11の実験は非常に重要です。
- 方法A: 過酸化水素水($H_2O_2$) に 酸化マンガン(IV)($MnO_2$) を加える。
$$2H_2O_2 \longrightarrow 2H_2O + O_2$$ - ポイント: $MnO_2$は反応の前後で変化しません。反応を早める手助けをするだけです。これを**触媒(しょくばい)**といいます。
- 方法B: 塩素酸カリウム($KClO_3$) に $MnO_2$ を加えて加熱する。
$$2KClO_3 \longrightarrow 2KCl + 3O_2$$
② 酸素の性質
- 助燃性(じょねんせい): 自分は燃えませんが、**「相手を燃やすのを助ける」**性質があります。
- 線香の火を入れると、炎を上げて激しく燃えます。
3. オゾン($O_3$):酸素の兄弟(p.234)
酸素($O_2$)と同じ「酸素原子(O)」だけでできているけれど、性質が違うものを**「同素体(どうそたい)」**と呼びます。
オゾン($O_3$)は酸素の同素体です。
① オゾンの作り方
- 酸素中で無声放電(火花を出さない放電)を行うと発生します。
$$3O_2 \longrightarrow 2O_3$$
② オゾンの特徴(酸素との違い)
- 色とにおい: 淡青色で、特有の生臭いにおい(ニンニク臭とも表現される)があります。
- 毒性: 有毒です。
- 酸化力: 酸素よりもずっと酸化力が強い(相手を酸化させる力が強い)ため、殺菌や漂白に使われます。
③ オゾンの検出反応(重要!)
オゾンの強い酸化力を確かめる実験です。
「ヨウ化カリウムデンプン紙」をオゾンにさらすと、青色になります。
$$2KI + O_3 + H_2O \longrightarrow I_2 + 2KOH + O_2$$
理由: オゾンがヨウ化物イオン($I^-$)を酸化してヨウ素($I_2$)にしてしまい、そのヨウ素がデンプンと反応して青くなるからです。
4. 硫黄($S$):3つの変身(p.234-235)
硫黄も「同素体」がテストの主役です。3種類の姿を必ず区別できるようにしましょう。
| 名前 | 斜方硫黄(しゃほういおう) | 単斜硫黄(たんしゃいおう) | ゴム状硫黄 |
| 化学式 | $S_8$ (環状分子) | $S_8$ (環状分子) | $S_x$ (鎖状分子) |
| 見た目 | 黄色の塊状結晶 | 淡黄色の針状結晶 | 褐色のゴム状 |
| 作り方 | $CS_2$溶液を蒸発させる | 溶けた硫黄をゆっくり冷やす | 沸騰硫黄を水に急冷する |
| 安定性 | 最も安定(常温) | 冷えると斜方硫黄に戻る | やがて斜方硫黄に戻る |
| 二硫化炭素($CS_2$)への溶解 | 溶ける | 溶ける | 溶けない |
覚え方のポイント
- 基本は「斜方硫黄」: 常温で放置すると、最終的にみんな「斜方硫黄」になります。
- ゴム状だけ特別:
- これだけ分子がリング状($S_8$)ではなく、長い鎖(鎖状)になっています。
- だから弾力があり、二硫化炭素($CS_2$)にも溶けません。
ここまでのまとめ
- 酸素の製法: 過酸化水素水($H_2O_2$)に触媒($MnO_2$)を加える。
- オゾン($O_3$): 淡青色、生臭い、酸化力が強い(ヨウ化カリウムデンプン紙を青変)。
- 硫黄の同素体:
- 斜方・単斜・ゴム状の3つ。
- 常温で安定なのは斜方硫黄。
- ゴム状硫黄だけは$CS_2$に溶けない。
危険な気体と硫酸の正体
1. 腐卵臭のガス:硫化水素 ($H_2S$)
温泉地に行くと漂う「腐った卵のようなにおい」。あれが硫化水素です。
① 作り方(実験室)
- 材料: 硫化鉄(II) ($FeS$) + 希硫酸(または希塩酸)
$$FeS + H_2SO_4 \longrightarrow FeSO_4 + H_2S$$ - ポイント: 弱酸の塩(FeS)に強酸を加えると、弱酸($H_2S$)が出てくる反応です(弱酸の遊離)。
② 性質(ここが狙われる!)
- 猛毒: 強い毒性があります。
- 弱酸性: 水に少し溶けて弱い酸性を示します。
- 強い還元力(重要): 相手から酸素を奪ったり、電子を与えたりする力が強いです。
- 例えば、二酸化硫黄($SO_2$)と出会うと、お互いに反応して**硫黄($S$)の沈殿(白濁)**ができます。
$$2H_2S + SO_2 \longrightarrow 2H_2O + 3S$$
③ 金属イオンの検出(黒くなる!)
硫化水素は、いろいろな金属イオンとくっついて水に溶けない沈殿を作ります。
特に、**鉛イオン($Pb^{2+}$)**を含んだ試験紙に吹きかけると、黒色に変色します。
$$Pb^{2+} + S^{2-} \longrightarrow PbS(黒色沈殿)$$
2. 刺激臭のガス:二酸化硫黄 ($SO_2$)
火山ガスなどに含まれる、鼻を突くような刺激臭のある気体です。
① 作り方
- 工業的: 硫黄($S$)や黄鉄鉱($FeS_2$)を燃やす。
- 実験室(重要): 銅($Cu$) に 濃硫酸 を加えて加熱する。
$$Cu + 2H_2SO_4 \longrightarrow CuSO_4 + 2H_2O + SO_2$$ - ※本来、銅は酸に溶けませんが、「熱濃硫酸」という強力な酸には溶けて$SO_2$を出します。
② 性質
- 水に溶けて酸性: 水に溶けると亜硫酸($H_2SO_3$)になり、酸性を示します。
- 漂白作用: 色素を分解して白くする作用があります(還元漂白)。紙や衣類の漂白に使われます。
- 還元剤ときどき酸化剤: 基本的には「還元剤」ですが、相手が最強の還元剤($H_2S$)のときだけは、「酸化剤」として働きます。
3. 化学工業の王様:硫酸 ($H_2SO_4$)
硫酸は、肥料、繊維、薬品などあらゆる産業で使われる超重要物質です。
**「作り方」と「濃硫酸 vs 希硫酸」**の違いをマスターしましょう。
① 工業的製法:「接触法(せっしょくほう)」
この名前と手順はテスト必出です!(p.238 図17)
- 硫黄を燃やす: $S + O_2 \longrightarrow SO_2$ (二酸化硫黄を作る)
- 酸化する(ここが核心): $SO_2$ をさらに酸化して $SO_3$(三酸化硫黄)にします。
- このとき、普通のやり方では反応が進まないため、酸化バナジウム(V) ($V_2O_5$) という触媒を使います。
$$2SO_2 + O_2 \longrightarrow 2SO_3$$
- 水に溶かす: 実際には濃硫酸に吸収させてから水で薄め、濃硫酸を完成させます。
② 「濃硫酸」の5つの性質(p.239)
水あめのようにドロっとした重い液体です。「ただの酸」ではありません。特殊能力を持っています。
- 不揮発性(ふきはつせい): 加熱しても蒸発しにくい。
- これを利用して、塩化ナトリウム等から塩酸(揮発しやすい酸)を作るのに使われます。
- 吸湿性(きゅうしつせい): 水分を強力に吸収する。
- 実験室で乾燥剤として使われます。
- 脱水作用(だっすいさよう): 化合物の中から、水素と酸素を$H_2O$(水)の形で無理やり引き抜きます。
- 砂糖($C_{12}H_{22}O_{11}$)にかけると、水が抜かれて**炭($C$)**になり、真っ黒こげになります。
- 溶解熱がすごい: 水に溶かすとものすごい熱を出します。
- 【安全上の注意】 薄めるときは、**「水に、濃硫酸を少しずつ加える」**こと!
- 逆(濃硫酸に水を注ぐ)をすると、水が沸騰して酸が飛び散り、大火傷します。
- 酸化作用(熱濃硫酸): 熱した濃硫酸は、銅や銀なども溶かす強力な酸化力を持ちます($SO_2$が発生)。
③ 「希硫酸」の性質(p.240)
濃硫酸を水で薄めたものが「希硫酸」です。こちらは**「ふつうの強い酸」**です。
- 金属を溶かす: イオン化傾向が水素より大きい金属(Zn, Feなど)を溶かして、**水素($H_2$)**を出します。
- ※濃硫酸のときのような特殊能力(脱水作用など)はありません。
4. 硫酸イオンの検出(p.240)
「この水溶液に硫酸イオン($SO_4^{2-}$)は入っているかな?」と調べる方法です。
- 試薬: **塩化バリウム($BaCl_2$)**水溶液を加える。
- 反応: 水に溶けない**「白色沈殿(硫酸バリウム $BaSO_4$)」**ができればビンゴです。
$$Ba^{2+} + SO_4^{2-} \longrightarrow BaSO_4(白)$$ - この沈殿は酸にも溶けません。バリウム検査(レントゲン)で飲む造影剤と同じ成分です。
全体のまとめ:ここだけは暗記!
- 硫化水素($H_2S$): 腐卵臭、猛毒。鉛イオンで黒変する。
- 二酸化硫黄($SO_2$): 刺激臭、漂白作用。銅+熱濃硫酸で作る。
- 硫酸の製法: 接触法(触媒は酸化バナジウム $V_2O_5$)。
- 濃硫酸の注意点: 必ず**「水に酸を加える」**。
- 濃硫酸の作用: 乾燥剤(吸湿性)や、砂糖を炭にする(脱水作用)。
- 検出反応: バリウムイオンで白色沈殿。
窒素・リンとアンモニア
1. 窒素族元素とは?(p.241)
周期表の15族(N, P, As, Sb, Bi)を窒素族と呼びます。
特に重要なのが、一番上の**窒素(N)と、その下のリン(P)**です。
① 窒素 ($N_2$):空気の主役
- 特徴: 空気の約78%(約4/5)を占める気体です。
- 安定性: 窒素分子($N \equiv N$)は、原子同士が「三重結合」という非常に強力なきずなで結ばれているため、常温では全く反応しません。
- だからこそ、ポテトチップスの袋に入れて酸化を防いだりするのに使われます。
② リン ($P$):光と炎
リンは自然界には単体で存在せず、岩石(リン鉱石)や動物の骨などに含まれています。
リンには有名な**「同素体」**が2つあります。この違いはテスト必出です!(表13)
| 特徴 | 黄リン(おうりん) | 赤リン(せきりん) |
| 化学式 | $P_4$ (正四面体形) | $P_x$ (網目状構造) |
| 毒性 | 猛毒 | なし(無毒) |
| 発火点 | 低い(約60℃)。空気中で自然発火する。 | 高い(約260℃)。自然発火しない。 |
| 保存 | 水中に保存(空気と触れさせないため) | ビンに入れて普通に保存 |
| 用途 | - | マッチの箱の側面(摩擦面) |
| リアクション | $CS_2$(二硫化炭素)によく溶ける | $CS_2$に溶けない |
覚え方:
「黄色い牙の猛獣が、水に潜んで自然発火!」(黄リン、猛毒、水中保存、自然発火)
赤リンはマッチの赤色だから安全、と覚えましょう。
2. アンモニア ($NH_3$):最強の塩基性ガス(p.242-243)
アンモニアは、「唯一の塩基性(アルカリ性)の気体」として非常に重要です。
① 工業的製法:「ハーバー・ボッシュ法」(p.242)
空気中の窒素($N_2$)と、水素($H_2$)から、直接アンモニアを作る方法です。
$$N_2 + 3H_2 \rightleftharpoons 2NH_3$$
- 触媒: 四酸化三鉄 ($Fe_3O_4$) を主成分とする触媒。
- 条件: 高温・高圧で行います。
- 歴史的意義: 空気から肥料(アンモニア)を作れるようになったため、「空気からパンを作る」と称えられました(コラム参照)。
② 実験室での製法(p.243)
- 材料: 塩化アンモニウム(アンモニアの塩)+ 水酸化カルシウム(強塩基)
$$2NH_4Cl + Ca(OH)_2 \longrightarrow CaCl_2 + 2H_2O + 2NH_3$$ - ポイント: 「弱塩基の塩」に「強塩基」をぶつけて、弱塩基(アンモニア)を追い出す反応です。
- 集め方: 空気より軽いので、上方置換法で集めます。
- 乾燥剤: アンモニアは塩基性なので、普通の乾燥剤(酸性の濃硫酸など)を使うと反応して吸収されてしまいます。そのため、ソーダ石灰(塩基性の乾燥剤)を使います。
③ アンモニアの性質(実験)
- 水への溶解: 水にものすごくよく溶けます。
- 噴水実験(図20): フラスコ内のアンモニアが水に溶けると気圧が下がり、水が勢いよく吸い上げられて噴水になります。フェノールフタレイン液を入れておくと、塩基性なので赤色になります。
- 白煙反応: 塩化水素($HCl$)と出会うと、真っ白な煙(塩化アンモニウムの固体粉末)を出します。
$$NH_3 + HCl \longrightarrow NH_4Cl$$ - 錯イオン形成: 銀イオン($Ag^+$)や銅イオン($Cu^{2+}$)などとくっついて、水に溶ける特殊なイオン(錯イオン)を作ります。
3. 一酸化窒素 ($NO$) の製法と性質(p.243-244)
ここからは「窒素の酸化物」シリーズです。まずは $NO$ です。
- 作り方(重要): 銅 ($Cu$) + 希硝酸
$$3Cu + 8HNO_3 \longrightarrow 3Cu(NO_3)_2 + 4H_2O + 2NO$$ - 性質:
- 無色の気体。
- 水に溶けにくい。
- 空気に触れると、すぐに酸化されて赤褐色の $NO_2$ になります。
$$2NO + O_2 \longrightarrow 2NO_2$$
まとめ
- 窒素($N_2$): 三重結合で安定。空気の78%。
- 黄リン: 自然発火する猛毒(水中保存)。
- 赤リン: マッチの摩擦面に使う(安全)。
- ハーバー法: $N_2 + 3H_2 \to 2NH_3$ (触媒は鉄)。
- アンモニアの性質: 水によく溶ける塩基性ガス。$HCl$と白煙を作る。
- 一酸化窒素($NO$): 銅+希硝酸で作る。無色。
赤褐色のガスと硝酸の力
1. 二酸化窒素 ($NO_2$):赤くて臭いガス(p.244)
前回学んだ一酸化窒素($NO$)は無色でしたが、こちらは色がついています。
① 作り方(超重要)
- 実験室: 銅 ($Cu$) + 濃硝酸
- 前回は「希」硝酸でしたが、今回は「濃」硝酸です。ここを区別することがテストの鉄則です!
$$Cu + 4HNO_3 \longrightarrow Cu(NO_3)_2 + 2H_2O + 2NO_2$$
② 性質
- 見た目: 赤褐色(赤茶色)の気体で、刺激臭があり有毒です。
- 水への溶解: 水によく溶けます。溶けると硝酸($HNO_3$)になります(後述のオストワルト法で利用)。
$$3NO_2 + H_2O \longrightarrow 2HNO_3 + NO$$ - 変身(平衡): 2つの分子がくっついたり離れたりします。
- $2NO_2$ (赤褐色) $\rightleftharpoons$ $N_2O_4$ (無色・四酸化二窒素)
- 冷やすと無色の$N_2O_4$になり、温めると赤褐色の$NO_2$に戻ります。
2. 硝酸 ($HNO_3$):強力な酸化剤(p.244-245)
硝酸は、火薬や肥料の原料になる非常に重要な酸です。
① 工業的製法:「オストワルト法」(p.244)
アンモニアから硝酸を作る方法です。3段階のドミノ倒しのような反応です。
- 第1段階(ここが肝): アンモニア($NH_3$)を白金($Pt$)触媒を使って酸化し、$NO$にします。
$$4NH_3 + 5O_2 \longrightarrow 4NO + 6H_2O$$ - 第2段階: できた$NO$を空気中でさらに酸化して$NO_2$にします。
$$2NO + O_2 \longrightarrow 2NO_2$$ - 第3段階: $NO_2$を温水に溶かして硝酸($HNO_3$)の完成です。
$$3NO_2 + H_2O \longrightarrow 2HNO_3 + NO$$ - ※余った$NO$は第2段階に戻して再利用します。
まとめの式:
$$NH_3 + 2O_2 \longrightarrow HNO_3 + H_2O$$
② 実験室的製法(p.245)
- 硝酸カリウム + 濃硫酸 $\longrightarrow$ 硝酸
- 揮発しやすい酸(硝酸)を、揮発しにくい酸(濃硫酸)を使って追い出す方法です。
3. 硝酸の特別な性質(ここがテストに出る!)
硝酸は「強い酸」であるだけでなく、「強い酸化剤(相手を溶かす力)」を持っています。
① 金属を溶かす力(p.245)
ふつうの酸(塩酸や希硫酸)には溶けない銅($Cu$)や銀($Ag$)も、硝酸には溶けます。
- 希硝酸を加える $\longrightarrow$ $NO$(無色) が出る。
- 濃硝酸を加える $\longrightarrow$ $NO_2$(赤褐色) が出る。
覚え方:
「希(き)でNo(ノー)、濃(のう)でNo.2(ノーツー)」
② 溶けない金属:「不動態(ふどうたい)」
逆に、アルミニウム($Al$)、鉄($Fe$)、ニッケル($Ni$)などは、濃硝酸には溶けません。
- 理由: 表面に緻密な酸化被膜ができてしまい、バリアとなって中を守るからです。この状態を不動態といいます。
③ 金も溶かす:「王水(おうすい)」
濃硝酸と濃塩酸を $1 : 3$ の体積比で混ぜた液を「王水」といいます。
これは非常に酸化力が強く、金($Au$)や白金($Pt$)さえも溶かします。
覚え方:
「一硝(いっしょう)三塩(さんえん)」= 硝酸1:塩酸3
④ 硝酸イオンの検出:「褐色環(かっしょくかん)反応」
「この液体に硝酸イオンは入っているかな?」と調べる実験です。
硫酸鉄(II)水溶液と濃硫酸を加えると、液の境目に褐色の輪ができます。Shutterstock
4. リンの化合物(p.246)
最後にリン(P)の化合物を2つだけ覚えましょう。
① 十酸化四リン ($P_4O_{10}$)
- 作り方: リンを燃やすと発生する白い煙(粉末)です。
$$P_4 + 5O_2 \longrightarrow P_4O_{10}$$ - 性質: ものすごい吸湿性(水を吸う力)があります。
- そのため、酸性の強力な乾燥剤として使われます。
② リン酸 ($H_3PO_4$)
- 作り方: 十酸化四リンを水と煮沸して反応させるとできます。
$$P_4O_{10} + 6H_2O \longrightarrow 4H_3PO_4$$ - 性質: 潮解性(空気中の水を吸ってベトベトになる)がある弱酸です。肥料の原料などに使われます。
全体のまとめ:窒素族の重要ポイント
この「窒素族」の単元で絶対に落としてはいけないポイントは以下の通りです。
- 気体の製法と色:
- $NO$(無色):銅 + 希硝酸
- $NO_2$(赤褐色):銅 + 濃硝酸
- オストワルト法:
- アンモニア($NH_3$) $\to$ $NO$ $\to$ $NO_2$ $\to$ 硝酸($HNO_3$)
- 触媒は白金($Pt$)。
- 金属との反応ルール:
- 不動態(溶けない): $Al, Fe, Ni$ + 濃硝酸
- 王水(金も溶かす): 濃硝酸 1 : 濃塩酸 3
- リンの化合物:
- $P_4O_{10}$ は強力な乾燥剤。
窒素・リンとアンモニア
1. 窒素族元素とは?(p.241)
周期表の15族(N, P, As, Sb, Bi)を窒素族と呼びます。
特に重要なのが、一番上の**窒素(N)と、その下のリン(P)**です。
① 窒素 ($N_2$):空気の主役
- 特徴: 空気の約80%(約4/5)を占める気体です。
- 安定性: 窒素分子($N \equiv N$)は、原子同士が「三重結合」という非常に強力なきずなで結ばれているため、常温では化学変化を起こしにくく安定です。
- だからこそ、食品の酸化防止(ポテトチップスの袋の中身など)に使われます。
② リン ($P$):光と炎
リンは自然界には単体で存在せず、岩石(リン鉱石)や動物の骨などに含まれています。
リンには有名な**「同素体」**が2つあります。この違いはテスト必出です!(p.242 表13)
| 特徴 | 黄リン(おうりん) | 赤リン(せきりん) |
| 化学式 | $P_4$ (正四面体形) | $P_x$ (網目状構造) |
| 毒性 | 極めて有毒(猛毒) | なし(無毒) |
| 発火点 | 低い(60℃)。空気中で自然発火する。 | 高い(260℃)。自然発火しない。 |
| 保存 | 水中に保存(空気と触れさせないため) | ビンに入れて普通に保存 |
| 用途 | - | マッチの箱の側面(摩擦面) |
| リアクション | $CS_2$(二硫化炭素)によく溶ける | $CS_2$に溶けない |
覚え方:
「黄色い牙の猛獣が、水に潜んで自然発火!」(黄リン、猛毒、水中保存、自然発火)
赤リンはマッチの赤色だから安全、と覚えましょう。
2. アンモニア ($NH_3$):最強の塩基性ガス(p.242-243)
アンモニアは、「唯一の塩基性(アルカリ性)の気体」として非常に重要です。
① 工業的製法:「ハーバー・ボッシュ法」(p.242)
空気中の窒素($N_2$)と、水素($H_2$)から、直接アンモニアを作る方法です。
$$N_2 + 3H_2 \rightleftharpoons 2NH_3 + 92.2 \text{kJ}$$
- 触媒: 四酸化三鉄 ($Fe_3O_4$) を主成分とする触媒。
- 条件: 高温(500℃)・高圧(200〜1000atm)で行います。
- 歴史的意義: 空気から肥料(アンモニア)を作れるようになったため、「空気からパンを作る」と称えられました(コラム参照)。
② 実験室での製法(p.243)
- 材料: 塩化アンモニウム(アンモニアの塩)+ 水酸化カルシウム(強塩基)
$$2NH_4Cl + Ca(OH)_2 \longrightarrow CaCl_2 + 2H_2O + 2NH_3$$ - ポイント: 「弱塩基の塩」に「強塩基」をぶつけて、弱塩基(アンモニア)を追い出す反応です。
- 集め方: 空気より軽いので、上方置換法で集めます。
- 乾燥剤: アンモニアは塩基性なので、酸性の乾燥剤(濃硫酸など)や塩化カルシウムを使うと反応してしまいます。そのため、ソーダ石灰(塩基性の乾燥剤)を使います。
③ アンモニアの性質(実験)
- 水への溶解: 水にものすごくよく溶けます。
- 噴水実験(図20): フラスコ内のアンモニアが水に溶けると気圧が下がり、水が勢いよく吸い上げられて噴水になります。フェノールフタレイン液を入れておくと、塩基性なので赤色になります。
- 白煙反応: 塩化水素($HCl$)と出会うと、真っ白な煙(塩化アンモニウムの固体粉末)を出します。
$$NH_3 + HCl \longrightarrow NH_4Cl$$ - 検出反応: ネスラー試薬を加えると、微量でも**赤褐色(〜黄褐色)**の沈殿を生じます。
3. 一酸化窒素 ($NO$) の製法と性質(p.243-244)
ここからは「窒素の酸化物」シリーズです。まずは $NO$ です。
- 作り方(重要): 銅 ($Cu$) + 希硝酸
$$3Cu + 8HNO_3 \longrightarrow 3Cu(NO_3)_2 + 4H_2O + 2NO$$ - 性質:
- 無色・無臭の気体。
- 水に溶けにくい。
- 空気に触れると、すぐに酸化されて赤褐色の $NO_2$ になります。
$$2NO + O_2 \longrightarrow 2NO_2$$
まとめ
- 窒素($N_2$): 三重結合で安定。空気の約80%。
- 黄リン: 自然発火する猛毒(水中保存)。
- 赤リン: マッチの摩擦面に使う(安全)。
- ハーバー法: $N_2 + 3H_2 \rightleftharpoons 2NH_3$ (触媒は$Fe_3O_4$)。
- アンモニアの性質: 水によく溶ける塩基性ガス。$HCl$と白煙を作る。
- 一酸化窒素($NO$): 銅+希硝酸で作る。無色。
赤褐色のガスと硝酸の力
1. 二酸化窒素 ($NO_2$):赤くて臭いガス(p.244)
前回学んだ一酸化窒素($NO$)は無色でしたが、こちらは色がついています。
① 作り方(超重要)
- 実験室: 銅 ($Cu$) + 濃硝酸
- 前回は「希」硝酸でしたが、今回は「濃」硝酸です。ここを区別することがテストの鉄則です!
$$Cu + 4HNO_3 \longrightarrow Cu(NO_3)_2 + 2H_2O + 2NO_2$$
② 性質
- 見た目: 赤褐色(赤茶色)の気体で、刺激臭があり有毒です。
- 水への溶解: 水によく溶けます。溶けると硝酸($HNO_3$)と亜硝酸($HNO_2$)になります(温水の場合は硝酸と一酸化窒素)。
- 温水での反応:$3NO_2 + H_2O \longrightarrow 2HNO_3 + NO$
- 変身(平衡): 2つの分子がくっついたり離れたりします。
- $2NO_2$ (赤褐色) $\rightleftharpoons$ $N_2O_4$ (無色・四酸化二窒素)
- 常温では赤褐色ですが、冷やすと無色の$N_2O_4$になり、温めると赤褐色の$NO_2$に戻ります。
2. 硝酸 ($HNO_3$):強力な酸化剤(p.244-245)
硝酸は、火薬や肥料の原料になる非常に重要な酸です。
① 工業的製法:「オストワルト法」(p.244)
アンモニアから硝酸を作る方法です。3段階のドミノ倒しのような反応です。
- 第1段階(ここが肝): アンモニア($NH_3$)と空気の混合気体を、白金($Pt$)触媒を使って酸化し、$NO$にします(約800℃)。
$$4NH_3 + 5O_2 \longrightarrow 4NO + 6H_2O$$ - 第2段階: できた$NO$を冷却して空気中でさらに酸化し、$NO_2$にします。
$$2NO + O_2 \longrightarrow 2NO_2$$ - 第3段階: $NO_2$を温水に溶かして硝酸($HNO_3$)の完成です。
$$3NO_2 + H_2O \longrightarrow 2HNO_3 + NO$$
まとめの式:
$$NH_3 + 2O_2 \longrightarrow HNO_3 + H_2O$$
(※この式は反応全体をまとめたものです)
② 実験室的製法(p.245)
- 硝酸カリウム ($KNO_3$) + 濃硫酸 ($H_2SO_4$) $\longrightarrow$ 硝酸
$$KNO_3 + H_2SO_4 \longrightarrow KHSO_4 + HNO_3$$ - 揮発しやすい酸(硝酸)を、揮発しにくい酸(濃硫酸)を使って追い出す方法です。
3. 硝酸の特別な性質(ここがテストに出る!)
硝酸は「強い酸」であるだけでなく、「強い酸化剤(相手を溶かす力)」を持っています。
① 保存方法(p.245)
- 光や熱で分解して有毒な$NO_2$を出してしまうため、褐色のびんに入れて冷暗所に保存します。
② 金属を溶かす力(p.245)
ふつうの酸(塩酸や希硫酸)には溶けない銅($Cu$)や銀($Ag$)も、硝酸には溶けます。
- 希硝酸を加える $\longrightarrow$ $NO$(無色) が出る。
$$3Cu + 8HNO_3 \longrightarrow 3Cu(NO_3)_2 + 4H_2O + 2NO$$ - 濃硝酸を加える $\longrightarrow$ $NO_2$(赤褐色) が出る。
$$Cu + 4HNO_3 \longrightarrow Cu(NO_3)_2 + 2H_2O + 2NO_2$$
覚え方:
「希(き)でNo(ノー)、濃(のう)でNo.2(ノーツー)」
③ 溶けない金属:「不動態(ふどうたい)」
逆に、アルミニウム($Al$)、鉄($Fe$)、ニッケル($Ni$)などは、濃硝酸には溶けません。
- 理由: 表面に緻密な酸化被膜ができてしまい、バリアとなって中を守るからです。この状態を不動態といいます。
④ 金も溶かす:「王水(おうすい)」
濃硝酸と濃塩酸を $1 : 3$ の体積比で混ぜた液を「王水」といいます。
これは非常に酸化力が強く、金($Au$)や白金($Pt$)さえも溶かします。
覚え方:
「一硝(いっしょう)三塩(さんえん)」= 硝酸1:塩酸3
⑤ 硝酸イオンの検出:「褐色環(かっしょくかん)反応」
「この液体に硝酸イオン($NO_3^-$)は入っているかな?」と調べる実験です。
硫酸鉄(II)($FeSO_4$)水溶液と濃硫酸を加えると、液の境目に褐色の輪ができます。Shutterstock
4. リンの化合物(p.246)
最後にリン(P)の化合物を2つだけ覚えましょう。
① 十酸化四リン ($P_4O_{10}$)
- 作り方: 黄リンや赤リンを燃やすと発生する白い煙(粉末)です。
$$P_4 + 5O_2 \longrightarrow P_4O_{10}$$ - 性質: ものすごい吸湿性(水を吸う力)があります。
- そのため、酸性の強力な乾燥剤や脱水剤として使われます。
② リン酸 ($H_3PO_4$)
- 作り方: 十酸化四リンを水に溶かして煮沸すると得られます。
$$P_4O_{10} + 6H_2O \longrightarrow 4H_3PO_4$$ - 性質: 潮解性(空気中の水を吸ってベトベトになる)がある無色の結晶で、水に溶かすと弱酸性を示します。
全体のまとめ:窒素族の重要ポイント
この「窒素族」の単元で絶対に落としてはいけないポイントは以下の通りです。
- 気体の製法と色:
- $NO$(無色):銅 + 希硝酸
- $NO_2$(赤褐色):銅 + 濃硝酸
- オストワルト法:
- アンモニア($NH_3$) $\to$ $NO$ $\to$ $NO_2$ $\to$ 硝酸($HNO_3$)
- 触媒は白金($Pt$)。
- 金属との反応ルール:
- 不動態(溶けない): $Al, Fe, Ni$ + 濃硝酸
- 王水(金も溶かす): 濃硝酸 1 : 濃塩酸 3
- リンの化合物:
- $P_4O_{10}$ は強力な乾燥剤。
炭素の変身と2つのガス
1. 炭素族元素とは?(p.247)
周期表の14族(C, Si, Ge, Sn, Pb)を炭素族といいます。
価電子(一番外側の電子)は4個です。
2. 炭素(C)の同素体(p.247)
炭素には、見た目も性質も全く違う「同素体」が4種類あります。それぞれの違いがテストに出ます。
| 同素体 | ダイヤモンド | 黒鉛(グラファイト) | 無定形炭素 | フラーレン |
| 構造 | 正四面体形(立体網目) | 正六角形(層状構造) | 不規則 | サッカーボール状 ($C_{60}$など) |
| 硬さ | 極めて硬い | 柔らかい(剝がれやすい) | - | - |
| 電気 | 通さない | よく通す | 通すものもある | - |
| 用途 | 宝石、研磨剤 | 鉛筆の芯、電極 | 木炭、活性炭 | 新素材 |
ポイント:
- ダイヤモンドは共有結合の結晶で、地球上で最も硬い物質の一つです。
- 黒鉛は電気を通します(※ダイヤモンドは通しません)。
- 活性炭は表面に小さな穴がたくさん空いていて、においなどを吸着する力があります(脱臭剤に使われます)。
3. 一酸化炭素(CO):静かなる暗殺者(p.248)
炭素が燃えるとき、酸素が足りないと発生する気体です。
① 作り方(重要)
- 実験室: ギ酸 ($HCOOH$) に 濃硫酸 を加えて加熱する。
$$HCOOH \longrightarrow H_2O + CO$$ - 濃硫酸の「脱水作用(水を引き抜く力)」を利用しています。
- 工業的: コークス(C)と二酸化炭素を反応させる。
② 性質(危険!)
- 猛毒: 吸い込むと、血液中のヘモグロビンと強力にくっつき、酸素を運べなくしてしまいます(一酸化炭素中毒)。
- 可燃性: 青白い炎を上げて燃えます。
$$2CO + O_2 \longrightarrow 2CO_2$$ - 還元作用(超重要): 相手から酸素を奪う力が強いです。これを利用して、鉄鉱石(酸化鉄)から鉄を取り出すのに使われます(溶鉱炉の反応)。
$$Fe_2O_3 + 3CO \longrightarrow 2Fe + 3CO_2$$
4. 二酸化炭素(CO₂):身近な酸性ガス(p.249)
① 作り方(実験室)
石灰石($CaCO_3$) に 希塩酸 を加える。
$$CaCO_3 + 2HCl \longrightarrow CaCl_2 + H_2O + CO_2$$
- 原理: 「弱酸の塩(炭酸カルシウム)」+「強酸(塩酸)」→「弱酸(二酸化炭素)が出る」という反応です。
② 性質
- 重い: 空気より重い気体です(下方置換法で集める)。
- ドライアイス: 固体になったものをドライアイスといいます。液体にならず直接気体になる**「昇華性」**があります。
- 弱酸性: 水に少し溶けて炭酸($H_2CO_3$)になり、弱い酸性を示します。
③ 検出反応(石灰水の変化)
二酸化炭素かどうかを確かめるには、**石灰水(水酸化カルシウム水溶液)**に通します。
- 白く濁る: 水に溶けない炭酸カルシウム($CaCO_3$)ができるからです。
$$Ca(OH)_2 + CO_2 \longrightarrow CaCO_3(白) + H_2O$$ - さらに通すと透明になる: 白く濁った後もしつこく$CO_2$を通し続けると、水に溶ける炭酸水素カルシウムに変化して透明に戻ります。
$$CaCO_3 + H_2O + CO_2 \longrightarrow Ca(HCO_3)_2(透明・溶解)$$
- 鍾乳洞ができる原理はこの反応です。
5. 炭酸塩の性質(p.250上半分)
炭酸イオン($CO_3^{2-}$)を含む化合物のルールです。
- 水に溶ける?: ナトリウムやカリウムの塩($Na_2CO_3$など)は溶けますが、カルシウムの塩($CaCO_3$)などは水に溶けません。
- 酸を加えると?: 二酸化炭素を出してシュワシュワ泡立ちます(上記$CO_2$の製法と同じ)。
- 熱すると?: 熱分解して$CO_2$を出します。
$$CaCO_3 \longrightarrow CaO + CO_2$$
まとめ
- 炭素の同素体: ダイヤ(硬い)、黒鉛(電気通す)、フラーレンなど。
- 一酸化炭素(CO): ギ酸の脱水で作る。毒性あり。還元作用(製鉄)あり。
- 二酸化炭素(CO₂): 石灰石+塩酸で作る。水溶液は弱酸性。
- 石灰水反応: $CO_2$を通すと白濁する。さらに通すと透明になる。
岩石からシリカゲルまで
1. ケイ素(Si):地球を覆う半導体(p.248)
炭素の下にある元素「ケイ素」は、酸素に次いで地球上に2番目に多く存在する元素です(岩石や砂の主成分です)。
① 作り方
自然界には単体(Si)では存在せず、酸化物($SiO_2$)として存在しています。
- 製法: ケイ砂($SiO_2$)にコークス(C)を混ぜて、電気炉でドロドロに熱して酸素を奪い取ります(還元)。
$$SiO_2 + 2C \longrightarrow Si + 2CO$$
② 性質
- 見た目: 灰色の金属光沢を持つ固体ですが、金属ではありません。
- 半導体: 電気を少しだけ通します。高純度のものは、IC(集積回路)や太陽電池の材料になります。
- 反応:
- 安定していますが、**水酸化ナトリウム($NaOH$)**のような強い塩基には溶けて水素を出します。
$$Si + 2NaOH + H_2O \longrightarrow Na_2SiO_3 + 2H_2$$
2. 二酸化ケイ素($SiO_2$):最強の石(p.250)
天然には「石英(せきえい)」や「水晶」、「ケイ砂」として存在します。ガラスの原料です。
① 構造と性質
- 構造: 1つのケイ素原子が4つの酸素原子と手をつなぎ、それが延々と続く**「共有結合の結晶(巨大分子)」**を作っています。
- 特徴: そのため、非常に硬く、融点が高く(約1700℃)、薬品にも強いです。
② 化学反応(ここがテストに出る!)
二酸化ケイ素は薬品にめったに反応しませんが、唯一の例外があります。
- フッ化水素酸(HF)にだけは溶ける!
- 重要: これが「ガラスに彫刻できる」理由です。
- ガラス(主成分$SiO_2$)を溶かして、ヘキサフルオロケイ酸($H_2SiF_6$)という物質になります。
$$SiO_2 + 6HF \longrightarrow H_2SiF_6 + 2H_2O$$
- 塩基(アルカリ)と融解して溶ける
- $SiO_2$は「酸性酸化物」の仲間なので、塩基($NaOH$や$Na_2CO_3$)と一緒に高温で加熱すると反応して溶けます。
$$SiO_2 + Na_2CO_3 \longrightarrow Na_2SiO_3 + CO_2$$ - ※この反応でできる「ケイ酸ナトリウム($Na_2SiO_3$)」が次の主役です。
3. ケイ酸とシリカゲル(p.251)
ここからの「物質の変化の流れ」は、セットで覚えましょう。
step 1:水ガラスを作る
先ほどの反応でできたケイ酸ナトリウム($Na_2SiO_3$)に水を加えて熱すると、透明で水あめのようなネバネバした液体になります。これを**「水ガラス」**といいます。
step 2:ケイ酸を作る
水ガラス(塩基性)に、塩酸(酸)を加えます。
すると、「弱酸の遊離」反応が起きて、白色のゼリー状の沈殿ができます。これが**ケイ酸($H_2SiO_3$)**です。
$$Na_2SiO_3 + 2HCl \longrightarrow H_2SiO_3(白沈) + 2NaCl$$
step 3:シリカゲルの完成!
ゼリー状のケイ酸を加熱して乾燥させると(脱水)、水分が抜けてスカスカの固体になります。これがシリカゲルです。
- なぜ乾燥剤になるの?
- シリカゲルには目に見えない微細な穴(細孔)が無数に空いており、そこに水分などの分子を吸着する性質があるからです。
- お菓子に入っている「食べられません」のアレです。
4. セラミックスと新素材(p.251)
- ケイ酸塩工業(窯業): $SiO_2$などを原料にして、ガラス、セメント、陶磁器などを作る工業のこと。
- 炭化ケイ素(SiC): 別名カーボランダム。ケイ素と炭素が結合したもので、ダイヤモンドと同じくらい硬く、研磨剤(やすり)に使われます。
$$SiO_2 + 3C \longrightarrow SiC + 2CO$$
全体のまとめ:ケイ素の流れをマスター
この単元は、以下の「しりとり」のような物質変化の流れが最重要です。
- 二酸化ケイ素($SiO_2$): 硬い石。**HF(フッ化水素)**にだけ溶ける。
$\downarrow$ ($Na_2CO_3$と加熱融解) - ケイ酸ナトリウム($Na_2SiO_3$): これを水に溶かすと水ガラス(ネバネバ)。
$\downarrow$ (塩酸を加える) - ケイ酸($H_2SiO_3$): 白いゼリー状の沈殿。
$\downarrow$ (乾燥させる) - シリカゲル: 多孔質で、乾燥剤として働く。
気体の作り方・完全攻略リスト
この表は、入試やテストで「この気体を作るには何を混ぜる?」と聞かれたときの答えそのものです。
「実験室での作り方(実)」と「工場での大量生産(工)」に分けて解説します。
1. 水素・希ガス・ハロゲン(p.252)
水素 ($H_2$)
- (実) 実験室: **亜鉛($Zn$)**などの金属に、**希硫酸($H_2SO_4$)**をかける。
$$Zn + H_2SO_4 \longrightarrow ZnSO_4 + H_2$$ - (工) 工業的: 石油などの炭化水素を分解したり、水の電気分解で作ります。
塩素 ($Cl_2$)
- (実) 実験室: 酸化マンガン(IV)($MnO_2$) に 濃塩酸($HCl$) を加えて加熱。
$$4HCl + MnO_2 \longrightarrow MnCl_2 + 2H_2O + Cl_2$$ - ※または、さらし粉に希塩酸を加えてもできます。
- (工) 工業的: 食塩水($NaCl$)の電気分解。
ハロゲン化水素 ($HCl, HF$)
ここは「濃硫酸」を使うのが共通点です。
- 塩化水素 ($HCl$): 塩化ナトリウム($NaCl$) に 濃硫酸 を加えて加熱。
$$NaCl + H_2SO_4 \longrightarrow NaHSO_4 + HCl$$ - フッ化水素 ($HF$): 蛍石($CaF_2$) に 濃硫酸 を加えて加熱。
$$CaF_2 + H_2SO_4 \longrightarrow CaSO_4 + 2HF$$
2. 酸素・硫黄の化合物(p.252)
酸素 ($O_2$)
- (実) 実験室:
- 過酸化水素水($H_2O_2$) に触媒($MnO_2$)を加える(加熱不要)。
$$2H_2O_2 \longrightarrow 2H_2O + O_2$$ - 塩素酸カリウム($KClO_3$) に触媒($MnO_2$)を加えて加熱。
- (工) 工業的: 液体空気の分留(蒸留)。
硫化水素 ($H_2S$)
- (実) 実験室: 硫化鉄(II)($FeS$) に 希硫酸(または希塩酸)を加える。
$$FeS + H_2SO_4 \longrightarrow FeSO_4 + H_2S$$ - 「弱酸の遊離」という反応です。
二酸化硫黄 ($SO_2$)
- (実) 実験室: 銅($Cu$) に 濃硫酸 を加えて加熱。
$$Cu + 2H_2SO_4 \longrightarrow CuSO_4 + 2H_2O + SO_2$$ - (工) 工業的: 硫黄($S$)や黄鉄鉱($FeS_2$)を燃やす。
3. 窒素の化合物(p.252下〜p.253上)
窒素 ($N_2$)
- (実) 実験室: 亜硝酸アンモニウムを熱分解する。
$$NH_4NO_2 \longrightarrow 2H_2O + N_2$$ - (工) 工業的: 液体空気の分留。
アンモニア ($NH_3$)
- (実) 実験室: 塩化アンモニウム と 消石灰(水酸化カルシウム) を混ぜて加熱。
$$2NH_4Cl + Ca(OH)_2 \longrightarrow CaCl_2 + 2H_2O + 2NH_3$$ - (工) 工業的: ハーバー法(窒素と水素を直接反応させる)。
窒素酸化物 ($NO, NO_2$)
銅($Cu$)と「硝酸」の濃さの違いがポイントでしたね。
- 一酸化窒素 ($NO$): 銅 + 希硝酸。
$$3Cu + 8HNO_3 \longrightarrow 3Cu(NO_3)_2 + 4H_2O + 2NO$$ - 二酸化窒素 ($NO_2$): 銅 + 濃硝酸。
$$Cu + 4HNO_3 \longrightarrow Cu(NO_3)_2 + 2H_2O + 2NO_2$$
4. 炭素の化合物(p.253上)
一酸化炭素 ($CO$)
- (実) 実験室: ギ酸($HCOOH$) に 濃硫酸 を滴下して加熱(脱水反応)。
$$HCOOH \longrightarrow H_2O + CO$$
二酸化炭素 ($CO_2$)
- (実) 実験室: 石灰石($CaCO_3$) に 希塩酸 を加える。
$$CaCO_3 + 2HCl \longrightarrow CaCl_2 + H_2O + CO_2$$ - (工) 工業的: 石灰石を高温で焼く(熱分解)。
$$CaCO_3 \longrightarrow CaO + CO_2$$
ここまでのポイント整理
気体の製法は、以下の「4つのパターン」で覚えると整理しやすいです。
- 酸を加えるだけ(弱酸の遊離など): $H_2, H_2S, CO_2$
- 酸化剤+酸+加熱(酸化還元): $Cl_2$
- 濃硫酸+加熱(揮発性酸の遊離・脱水): $HCl, HF, CO$
- 銅+酸(酸化還元): $SO_2, NO, NO_2$
気体の「色・におい・集め方」
1. 「色」がついている気体(超重要)
高校化学で出てくる気体のほとんどは「無色」です。
だからこそ、色がついている「例外」だけを覚えればOKです。この表の中では2つだけです。
- 塩素 ($Cl_2$) $\longrightarrow$ 黄緑色
- 二酸化窒素 ($NO_2$) $\longrightarrow$ 赤褐色(赤茶色)
補足: この表にはありませんが、オゾン($O_3$)は「淡青色」、フッ素($F_2$)は「淡黄色」でしたね。これら以外は「無色」と答えれば正解です。
2. 「におい」の分類
においも3つのグループに分けると覚えやすいです。
- 刺激臭(鼻を突くツーンとするにおい):
- 酸性・塩基性の気体に多いです。
- $Cl_2, HCl, HF, SO_2, NO_2, NH_3$
- ※特にアンモニア($NH_3$)は強烈です。
- 腐卵臭(腐った卵のにおい):
- 硫化水素 ($H_2S$) だけ!
- 無臭(においなし):
- $H_2, O_2, N_2, CO, CO_2, NO$
- ※一酸化炭素($CO$)は毒ですが、においがないので気づかないのが怖いところです。
3. 気体の「集め方」のルール
気体の集め方は3種類ありますが、どれを使うかは**「水に溶けるか?」と「重さは?」**で自動的に決まります。
① 水上置換法(水の中で集める)
- 条件: 水に溶けにくい気体。
- メリット: 純粋な気体が集めやすい。
- 該当する気体:
- $H_2, O_2, N_2, CO, NO$
- ※$NO$(一酸化窒素)は、空気に触れるとすぐ酸化されて$NO_2$になってしまうので、絶対に水上置換でないといけません。
② 下方置換法(ビンの底にためる)
- 条件: 水に溶けやすく、空気より重い気体。
- 該当する気体:
- $Cl_2, HCl, H_2S, SO_2, NO_2, CO_2$
- ※分子量が空気の平均分子量(約28.8)より大きいものが「重い」です。たとえば$CO_2$は分子量44なので重いです。
③ 上方置換法(ビンの天井にためる)
- 条件: 水に溶けやすく、空気より軽い気体。
- 該当する気体:
- アンモニア ($NH_3$)
- ※この表の中で、上方置換なのはアンモニアだけです!「軽い・水に溶ける・塩基性」といえばアンモニアです。
例外:フッ化水素($HF$)
$HF$は水にめちゃくちゃ溶けますが、沸点が19.5℃と高く、常温では液体になりかけの状態だったりするため、下方置換で集めることが多いですが、この表では集め方の記載が省略されています。
4. 液性のまとめ(リトマス紙の変化)
最後に、水に溶けたとき何性になるかです。
- 塩基性(アルカリ性):
- アンモニア ($NH_3$) ひとつだけ!
- 赤色リトマス紙を青く変えます。
- 酸性:
- $Cl_2, HCl, HF, H_2S, SO_2, NO_2, CO_2$
- 青色リトマス紙を赤く変えます。
- ※$Cl_2$は水と反応して塩酸と次亜塩素酸を作るので酸性を示します。
- 中性(溶けにくいもの):
- $H_2, O_2, N_2, CO, NO$
全体の総まとめ:テスト直前チェック
今回アップロードしていただいた教科書の範囲(無機物質)を攻略するコツは、**「例外」や「唯一のもの」**を優先して覚えることです。
- 唯一の塩基性ガス $\to$ アンモニア
- 唯一の腐卵臭 $\to$ 硫化水素
- 唯一の上方置換 $\to$ アンモニア
- 色付きガス $\to$ 塩素(黄緑)、二酸化窒素(赤褐)、オゾン(淡青)
- 水に溶けない(水上置換) $\to$ $H_2, O_2, N_2, CO, NO$ (ノコノコお水に入る、と覚えたりします)
暴れん坊「アルカリ金属」
1. アルカリ金属の単体(p.254, 256)
周期表の一番左、1族の元素(Hは除く)をアルカリ金属といいます。
メンバーは、リチウム(Li)、ナトリウム(Na)、カリウム(K)、ルビジウム(Rb)、セシウム(Cs)です。
① 性質:「軽い・柔い・溶けやすい」
- 密度: 金属なのにとても軽く、水に浮くものもあります。
- 硬さ: ナイフで簡単に切れるほど柔らかいです。
- 融点: 比較的低い温度で溶けます(Naは約98℃)。
② 反応性:「水禁止!」
アルカリ金属は、原子番号が大きくなるほど(下に行くほど)反応性が激しくなります。
- 水との反応(危険!):
- 水に入れると、激しく反応して水素($H_2$)を出し、残った水溶液は強い塩基性になります。
$$2Na + 2H_2O \longrightarrow 2NaOH + H_2$$
- 空気との反応:
- 切断面は銀白色ですが、すぐに空気中の酸素と反応してさびてしまいます。
- 保存方法:
- 空気とも水とも反応してしまうため、石油(灯油)の中に保存します。
③ 炎色反応(花火の色)
アルカリ金属を炎の中に入れると、特有の色がつきます。これを炎色反応といいます。
テストでは「色」の暗記が必須です。
| 元素 | Li (リチウム) | Na (ナトリウム) | K (カリウム) | Rb (ルビジウム) | Cs (セシウム) |
| 色 | 赤 (深赤) | 黄 | 赤紫 | 深赤 | 青紫 |
有名な語呂合わせ:
「リアカー(Li 赤) なき(Na 黄) K村(K 紫) 借(Ca 橙)りとう(Sr 紅) する(Sr) べ(Ba 黄緑) くれない(紅)」
※Ca, Sr, Baは2族ですが、一緒に覚えるのが定番です。
2. ナトリウムの化合物(p.256-257)
① 水酸化ナトリウム ($NaOH$)
別名:苛性(かせい)ソーダ。皮膚を溶かす危険な物質です。
- 潮解性(ちょうかいせい): 空気中に置いておくと、水分を吸ってベトベトに溶けてしまいます。
- 二酸化炭素を吸収: 空気中の$CO_2$を吸ってしまうため、保存時は栓をしっかり閉める必要があります。
$$2NaOH + CO_2 \longrightarrow Na_2CO_3 + H_2O$$
② 炭酸ナトリウム ($Na_2CO_3$) と 炭酸水素ナトリウム ($NaHCO_3$)
名前が似ているこの2人兄弟の違いは、テストの頻出ポイントです(表17)。
| 性質 | 炭酸ナトリウム (Na2CO3) | 炭酸水素ナトリウム (NaHCO3) |
| 通称 | 炭酸ソーダ | 重曹(ベーキングパウダー) |
| 水溶性 | よく溶ける | 少し溶ける |
| 液性 | かなり強い塩基性 | 弱い塩基性 |
| 熱分解 | しない | 分解して$CO_2$を出す |
| 用途 | ガラス原料 | 発泡入浴剤、ふくらし粉 |
共通点: どちらも塩酸を加えると**二酸化炭素($CO_2$)**が発生します。
3. アンモニアソーダ法(ソルベー法)(p.257-258)
「食塩($NaCl$)」と「石灰石($CaCO_3$)」という安い材料から、ガラスの原料になる「炭酸ナトリウム($Na_2CO_3$)」を大量生産する、魔法のような工業的製法です。
流れ(5つのステップ) をざっくり理解しましょう。
- 食塩水にアンモニアと二酸化炭素を吹き込む:
- すると、水に溶けにくい**炭酸水素ナトリウム($NaHCO_3$)**が沈殿します。
$$NaCl + NH_3 + H_2O + CO_2 \longrightarrow NaHCO_3 \downarrow + NH_4Cl$$
- 焼く(熱分解):
- 沈殿した$NaHCO_3$を取り出して焼くと、目的の**炭酸ナトリウム($Na_2CO_3$)**が完成します。
$$2NaHCO_3 \longrightarrow Na_2CO_3 + H_2O + CO_2$$
- リサイクル(ここがすごい):
- 使ったアンモニアや二酸化炭素は、石灰石を焼いたり反応させたりして回収し、また最初の工程に戻して再利用します。無駄がないのがこの製法の特徴です。
まとめ
- アルカリ金属(Li, Na, K...): 水と激しく反応して水素を出す。石油中に保存。
- 炎色反応: Li(赤)、Na(黄)、K(紫)。
- NaOH: 潮解性がある強塩基。
- $NaHCO_3$(重曹): 熱分解して$CO_2$を出す(ふくらし粉)。
- アンモニアソーダ法: 食塩から$Na_2CO_3$を作る工業的製法。
2族元素とカルシウムの旅
1. 2族元素と「アルカリ土類金属」(p.259)
周期表の2族(Be, Mg, Ca, Sr, Ba, Ra)ですが、ここには少し細かい「呼び名のルール」があります。
① 「アルカリ土類金属」の定義
- Ca, Sr, Ba, Ra の4つ $\longrightarrow$ アルカリ土類金属と呼びます。
- Be, Mg の2つ $\longrightarrow$ アルカリ土類金属には含めません(性質が少し違うため区別します)。
② 水との反応(違いが出る!)
アルカリ金属(1族)は爆発的に反応しましたが、2族は少し大人しいです。
| 元素 | Mg (マグネシウム) | Ca, Sr, Ba (アルカリ土類) |
| 常温の水 | 反応しない | 反応して水素を出す |
| 熱水 | 反応する | 激しく反応する |
| 炎色反応 | なし | 色が出る |
炎色反応の色(暗記)
- Ca(カルシウム):橙赤色(とうせきしょく)
- Sr(ストロンチウム):深赤色(しんせきしょく)
- Ba(バリウム):黄緑色
2. カルシウムの化合物:石灰のサイクル(p.259-260)
ここがこの単元のハイライトです。石灰石($CaCO_3$)を出発点にして、加熱したり水を加えたりすると、物質がぐるぐる変化します。
step 1:焼く(石灰石 $\to$ 生石灰)
石灰石(炭酸カルシウム $CaCO_3$)を高温で焼くと、二酸化炭素が抜けて**生石灰(酸化カルシウム $CaO$)**になります。
$$CaCO_3 \longrightarrow CaO + CO_2$$
step 2:水を加える(生石灰 $\to$ 消石灰)
生石灰($CaO$)に水を加えると、ものすごい熱(発熱)を出して**消石灰(水酸化カルシウム $Ca(OH)_2$)**になります。
$$CaO + H_2O \longrightarrow Ca(OH)_2 + \text{熱}$$
- $CaO$は水分を吸うので、お菓子などの乾燥剤としても使われます。
step 3:水に溶かす(石灰水)
消石灰($Ca(OH)_2$)を水に溶かした上澄み液が、実験でおなじみの**「石灰水」**です。強い塩基性を示します。
step 4:息を吹き込む(石灰水 $\to$ 白濁)
石灰水に二酸化炭素($CO_2$)を通すと、元の**炭酸カルシウム($CaCO_3$)**に戻り、水に溶けないので白く濁ります。
$$Ca(OH)_2 + CO_2 \longrightarrow CaCO_3 \downarrow (\text{白}) + H_2O$$
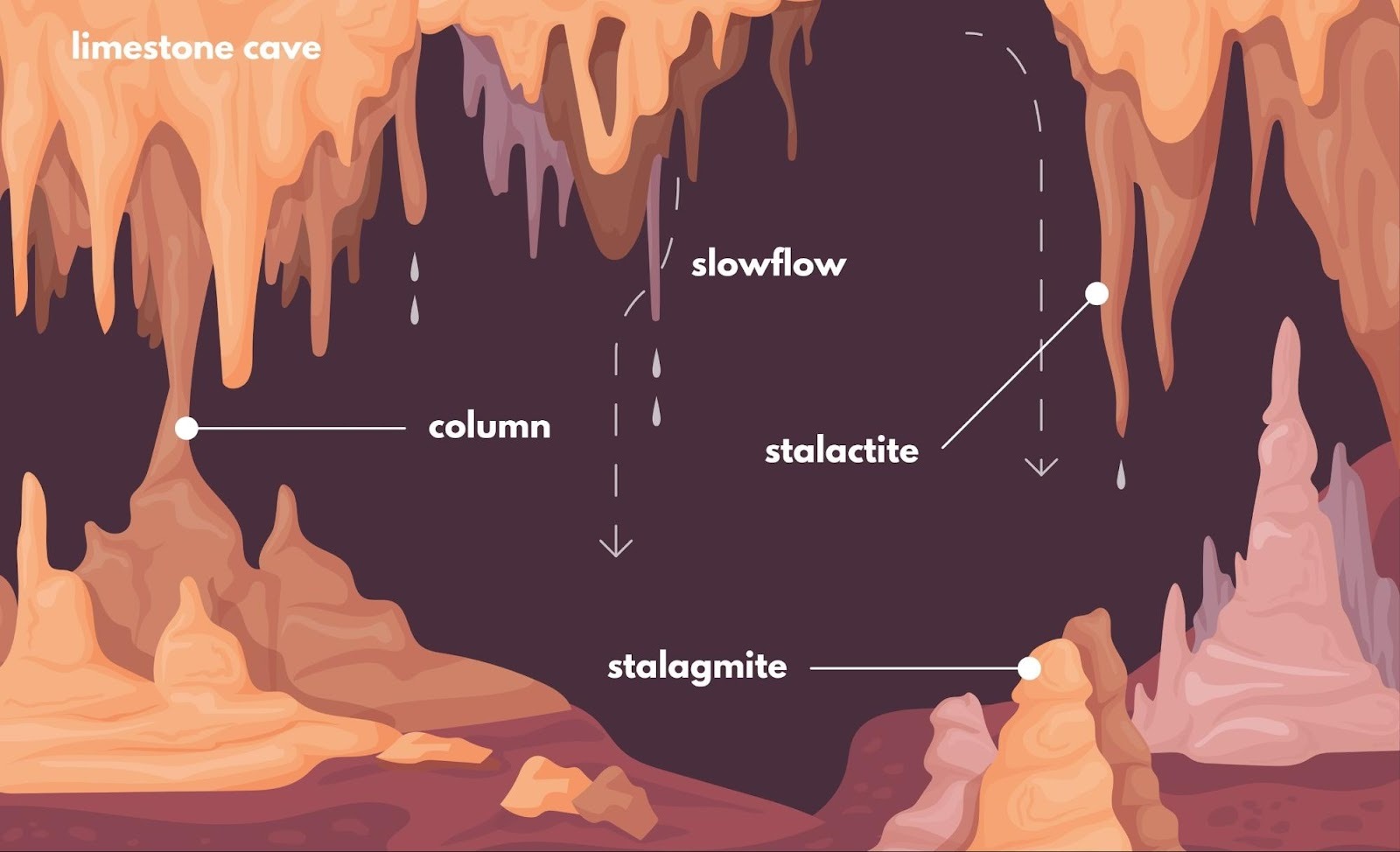
3. 鍾乳洞ができる仕組み(p.260)
「白く濁った石灰水に、さらにしつこく$CO_2$を吹き込み続けるとどうなるか?」
実は、透明に戻ります。
- 反応: 炭酸カルシウムが、水に溶ける「炭酸水素カルシウム」に変身するからです。
$$CaCO_3 + H_2O + CO_2 \rightleftharpoons Ca(HCO_3)_2$$ - 鍾乳洞(しょうにゅうどう):
- $CO_2$を含んだ雨水が石灰岩($CaCO_3$)を溶かして洞窟を作り(右へ進む反応)、
- 洞窟の中で水分や$CO_2$が抜けると再び$CaCO_3$の結晶(鍾乳石)が現れる(左へ戻る反応)現象です。
 Shutterstock
Shutterstock
詳しく見る
4. セッコウとその他の化合物(p.260-261)
① 硫酸カルシウム(セッコウ)
セッコウ(石膏)は美術室にある白い像や、骨折したときのギプスの材料です。
- セッコウ($CaSO_4 \cdot 2H_2O$): 水を2つ持っている状態。
- 焼きセッコウ($CaSO_4 \cdot \frac{1}{2}H_2O$): 焼いて水を減らした粉末。
- 特徴: 焼きセッコウに水を混ぜると、発熱して膨張し、すぐに固まってセッコウに戻ります。これを利用して型取りをします。
② 硫酸バリウム ($BaSO_4$)
- 性質: 水にも酸にも全く溶けない、非常に安定な白色粉末です。
- 用途: X線撮影の造影剤(バリウム検査)に使われます。
③ 塩化マグネシウム ($MgCl_2$)
- 性質: 海水に含まれ、潮解性(ドロドロになる性質)があります。
- 用途: 豆腐を固める**「にがり」**の主成分です。
④ 塩化カルシウム ($CaCl_2$)
- 用途: 乾燥剤や、冬の道路の融雪剤(凍結防止剤)として使われます。
全体の総まとめ:無機化学のフィナーレ
これで、今回頂いた全ての画像の解説が完了しました!
最後に、2族元素の重要ポイントを整理します。
- アルカリ土類金属: Ca, Sr, Ba, Ra。(Be, Mgは含まない)。
- 反応性の違い: Mgは熱水と反応。Caなどは冷水とも反応。
- 石灰のサイクル:
- $CaCO_3$ (石灰石) $\xrightarrow{\text{焼く}}$ $CaO$ (生石灰) $\xrightarrow{\text{水}}$ $Ca(OH)_2$ (消石灰) $\xrightarrow{CO_2}$ $CaCO_3$ (白濁)。
- 鍾乳洞反応: $CO_2$過剰で透明になる($Ca(HCO_3)_2$)。
- セッコウ: 水を加えると固まる。
変幻自在の金属「アルミニウム」
1. アルミニウムの単体(p.262)
アルミニウム($Al$)は、1円玉やアルミ箔など身近な金属ですが、実はすごい能力を隠し持っています。
① 基本的な性質
- 軽い: 密度が小さい軽金属です。
- 電気・熱をよく通す: 鍋や送電線に使われます。
- 不動態(ふどうたい): 空気中では表面に緻密な酸化膜ができるため、内部までさびません(人工的にこの膜を厚くしたのが「アルマイト」です)。
② テルミット反応(豪快な実験!)
アルミニウムの粉末と、酸化鉄(サビ)を混ぜて火をつけると、ものすごい熱と光を出して燃えます。
- 仕組み: アルミニウムは酸素とくっつきたい欲求が強いため、酸化鉄から酸素を暴力的に奪い取ります。その熱で鉄がドロドロに溶けて出てきます。
$$2Al + Fe_2O_3 \longrightarrow Al_2O_3 + 2Fe$$ - ※この熱は、レールの溶接などに使われます。
③ 「両性元素」である(超重要)
ここがテストのハイライトです。普通の金属は「酸」には溶けますが、「塩基」には溶けません。
しかし、アルミニウムは酸とも強塩基とも反応して、水素を出して溶けます。
- 酸 ($HCl$) との反応:
$$2Al + 6HCl \longrightarrow 2AlCl_3 + 3H_2$$ - 強塩基 ($NaOH$) との反応:
$$2Al + 2NaOH + 6H_2O \longrightarrow 2Na[Al(OH)_4] + 3H_2$$ - 生成する $Na[Al(OH)_4]$ は「テトラヒドロキソアルミン酸ナトリウム」といいます。舌を噛みそうな名前ですが、**「錯(さく)イオン」**という水に溶ける形に変身しています。
2. アルミニウムの化合物(p.263)
① 酸化アルミニウム ($Al_2O_3$)
- 通称: アルミナ。
- 特徴: 非常に硬く、融点が高い。
- 宝石: 結晶として美しいものが**ルビー(赤)やサファイア(青)**です。
- 両性酸化物: 酸とも強塩基とも反応して溶けます。
② 水酸化アルミニウム ($Al(OH)_3$)
- 見た目: 白色のゼリー状沈殿です。
- 両性水酸化物: これも酸・強塩基の両方に溶けます。
3. 「沈殿」と「溶解」のパズル(p.263 図41)
ここが最もテストに出る「実験操作」です。
「アルミニウムイオン($Al^{3+}$)が入った液」に、水酸化ナトリウムを「少し」入れた場合と、「大量に」入れた場合で結果が変わります。
実験の流れ(ストーリーで覚える!)
- スタート: 透明な $Al^{3+}$ の水溶液。
- 水酸化ナトリウムを「少量」加える:
- 白色ゼリー状沈殿 ($Al(OH)_3$) ができる。
- 「まだ溶けないよ!」
- 水酸化ナトリウムを「過剰に(大量に)」加える:
- 沈殿が溶けて、無色透明になる!
- 理由:錯イオン $[Al(OH)_4]^-$ になって水に溶けるから。
ひっかけ注意!「アンモニア」の場合
もし、加えるのが強塩基($NaOH$)ではなく、**弱塩基(アンモニア $NH_3$)**だったら?
- 少量: 沈殿する ($Al(OH)_3$)。
- 過剰: 溶けない!(沈殿のまま)。
- 理由: アンモニアは弱すぎて、アルミニウムを錯イオンに変える力がないからです。
結論: 「一度できた沈殿を溶かしたければ、強塩基を使え!」
4. ミョウバン(p.264)
- ミョウバン ($AlK(SO_4)_2 \cdot 12H_2O$)
- 硫酸アルミニウムと硫酸カリウムを混ぜて濃縮するとできる、きれいな正八面体の結晶です。
- 2種類の塩が合体したものを**「複塩(ふくえん)」**といいます。
- 水に溶かすと、元のイオン($Al^{3+}, K^{+}, SO_4^{2-}$)にバラバラに戻ります。
まとめ
- 両性元素: アルミニウムは酸とも強塩基とも反応して水素を出す。
- 不動態: 濃硝酸には溶けない。
- テルミット反応: $Al$の粉末で酸化鉄を還元し、高熱を出す。
- 沈殿反応(最重要):
- $Al^{3+}$ + 少量の塩基 $\to$ 白沈 $Al(OH)_3$
- 白沈 + 過剰の$NaOH$ $\to$ 溶解(無色)
- 白沈 + 過剰の$NH_3$ $\to$ 溶けない
両性元素の仲間と水銀
1. 亜鉛(Zn):アルミニウムのライバル(p.265-266)
亜鉛は電池の負極やトタン(鉄へのメッキ)に使われる身近な金属です。
① 両性元素としての性質
アルミニウムと同様に、酸とも強塩基とも反応して水素を出して溶けます。
- 酸 ($HCl$) との反応:
$$Zn + 2HCl \longrightarrow ZnCl_2 + H_2$$ - 強塩基 ($NaOH$) との反応:
$$Zn + 2NaOH + 2H_2O \longrightarrow Na_2[Zn(OH)_4] + H_2$$ - 生成するのは「テトラヒドロキソ亜鉛(II)酸ナトリウム」です。
② 沈殿反応:ここがアルミニウムとの決定的な違い!
「亜鉛イオン($Zn^{2+}$)」を含む水溶液に塩基を加える実験操作を整理します。これがテストの識別ポイントです。
- 少量の塩基:
- 白色沈殿 ($Zn(OH)_2$) ができる。これはAlと同じ。
- 過剰の強塩基 ($NaOH$):
- 溶ける(錯イオン $[Zn(OH)_4]^{2-}$ になる)。これもAlと同じ。
- 過剰のアンモニア ($NH_3$):
- 溶ける!!(錯イオン $[Zn(NH_3)_4]^{2+}$ になる)
- ★ここが重要: アルミニウムの沈殿はアンモニアには溶けませんでしたが、亜鉛の沈殿はアンモニアに溶けます。
- できる錯イオンの名前:「テトラアンミン亜鉛(II)イオン」
覚え方:
「あ(Al)あ(亜鉛)すん(Sn)なり(Pb)両性元素」
「亜鉛(あえん)はアンモニア(あ)に溶ける」 と覚えましょう。
2. 水銀(Hg):唯一の液体金属(p.266)
- 性質: 常温で唯一の液体の金属です。
- アマルガム: 鉄・ニッケル以外の金属と合金を作りやすい性質があります。水銀との合金をアマルガムといいます(昔は歯の詰め物に使われていました)。
- 毒性: 蒸気や化合物には強い毒性があります。
3. スズ(Sn)と鉛(Pb):14族の重鎮(p.266-267)
炭素やケイ素と同じ「14族」の下の方にいる金属です。これらも両性元素です。
① スズ(Sn)
- ブリキ: 鉄の表面にスズをメッキしたもの(缶詰の内側など)。
- ※「亜鉛」メッキは「トタン」です。区別しましょう。
- 同素体:
- 白色スズ(常温): 金属光沢がある。
- 灰色スズ(低温): 低温になるとボロボロ崩れる粉末状になる(スズペストと呼ばれる現象)。
② 鉛(Pb)
- 性質: 密度が大きく(重い)、放射線を遮る能力が高い(レントゲン室の壁などに利用)。
- 溶けにくい塩(沈殿):
- 多くの塩化物は水に溶けますが、塩化鉛($PbCl_2$)は水に溶けにくく、白色沈殿します。
- ただし、「熱水」には溶けるという特徴があります。これが鉛の識別ポイントです。
- 硫酸鉛($PbSO_4$)も水に溶けない白色沈殿です(鉛蓄電池の電極で有名)。
全体の総まとめ:両性元素4兄弟のルール
教科書p.267の表20と「まとめ」ボックスの内容が、この単元の全てです。
- 両性元素のメンバー: Al, Zn, Sn, Pb (ああすんなり)。
- これらは、酸とも強塩基とも反応して溶ける。
- 単体だけでなく、酸化物や水酸化物も同じく両性を示す(酸・塩基両方に溶ける)。
- 錯イオンを作る相手(過剰添加):
- $NaOH$(強塩基): 4人とも全員溶ける。
- $NH_3$(アンモニア): Zn(亜鉛)だけが溶ける。他は沈殿のまま。
- メッキの違い:
- トタン = 鉄 + 亜鉛 (Zn)
- ブリキ = 鉄 + スズ (Sn)
カラフルな「遷移元素」と「錯イオン」
1. 遷移元素とは?(p.269)
周期表の3族〜11族にある元素を「遷移元素」といいます。
これまでの典型元素とは、キャラが大きく異なります。
① 横並びの仲良しグループ
- 典型元素: 縦(族)が同じなら性質が似ていました。
- 遷移元素: 横(周期)の並びでも性質がよく似ています。
- 理由: 原子番号が増えても、一番外側の電子(価電子)の数は「1個か2個」のままで、内側の電子が増えていくという特殊な増え方をするからです。
② 遷移元素の4つの特徴(超重要)
典型元素の金属(AlやZnなど)と区別するために、この4つの特徴を覚えましょう。
- すべて金属である(重金属が多く、融点が高い)。
- いろいろな酸化数をとる。
- 例:マンガン(Mn)は $+2, +4, +7$ など、状況によって手が何本にも変わります。
- イオンや化合物に「色」がついているものが多い。
- 典型元素のイオン($Na^+, Al^{3+}$など)は無色ですが、遷移元素($Cu^{2+}$は青、$Fe^{3+}$は黄褐など)はカラフルです。
- 錯(さく)イオンをつくりやすい。
2. 「錯イオン」ってなに?(p.270-271)
金属イオンが、服を着るように他の分子を身にまとって、一つの巨大なイオンになったものを**「錯イオン」**といいます。
① 構造の仕組み
- 中心金属: 真ん中にいる金属イオン($Cu^{2+}, Ag^+$など)。
- 配位子(はいいし): 金属にくっつく分子やイオン($NH_3, H_2O, CN^-, Cl^-$など)。
- 配位結合: 配位子が持っている「非共有電子対(あまっている電子ペア)」を、金属イオンに一方的に貸してあげることでくっつきます。
② 形と数(テストに出る組み合わせ!)
「どの金属」に「何個」くっついて、「どんな形」になるかは決まっています。以下の表を暗記しましょう(p.271 図50)。
| 金属イオン | 配位数(くっつく数) | 形 | 代表的な錯イオン | 色 |
| $Ag^+$ (銀) | 2 | 直線型 | $[Ag(CN)_2]^-$
ジシアノ銀(I)酸イオン | 無色 |
| $Zn^{2+}$ (亜鉛) | 4 | 正四面体 | $[Zn(NH_3)_4]^{2+}$
テトラアンミン亜鉛(II)イオン | 無色 |
| $Cu^{2+}$ (銅) | 4 | 正方形 | $[Cu(NH_3)_4]^{2+}$
テトラアンミン銅(II)イオン | 深青色 |
| $Fe^{2+}, Fe^{3+}$ | 6 | 正八面体 | $[Fe(CN)_6]^{3-}$など | 黄色等 |
覚え方のコツ(数と形):
- 銀 ($Ag$): 手は2本で、真っ直ぐ(直線)。
- 亜鉛 ($Zn$): 手は4本で、バランスよく広がる(正四面体)。
- 銅 ($Cu$): 手は4本だけど、ペチャンコ(正方形)。
- 鉄 ($Fe$): 手は6本(正八面体)。
③ 名前の付け方(p.270-271)
呪文のように聞こえますが、ルール通りに読んでいるだけです。
例:$[Cu(NH_3)_4]^{2+}$
- 数: 4つあるので「テトラ」(1:モノ, 2:ジ, 3:トリ, 4:テトラ, 6:ヘキサ)。
- 配位子: アンモニアは「アンミン」。
- 金属: 「銅(II)」。
- 最後: 陽イオンなら「〜イオン」、陰イオンなら「〜酸イオン」。
$\to$ つなげて**「テトラ・アンミン・銅(II)・イオン」**となります。
第10章(前編)のまとめ
- 遷移元素: 3〜11族。すべて金属。色付きイオン、多様な酸化数、錯イオン形成が特徴。
- 錯イオン: 金属イオンに非共有電子対を持つ分子(配位子)が配位結合したもの。
- 形の暗記:
- $Ag^+$ (2, 直線)
- $Zn^{2+}$ (4, 正四面体)
- $Cu^{2+}$ (4, 正方形)
- $Fe^{2+/3+}$ (6, 正八面体)
- 銅の錯イオン: アンモニアを加えると深青色になる(超頻出)。
鉄のドラマと合金のレシピ
1. 鉄(Fe):文明を支える金属(p.272-273)
① 2種類の「サビ」
鉄は湿った空気中ではすぐに錆びますが、実はサビには2種類あります。
- 赤さび ($Fe_2O_3$):
- 湿った空気中で自然にできる赤褐色のサビ。
- 内部までボロボロにしてしまう悪いサビです。
- 黒さび ($Fe_3O_4$):
- 鉄を空気中で強熱するとできる黒色のサビ(四酸化三鉄)。
- 表面を緻密に覆うので、内部を保護する役割があります(中華鍋が黒いのはこれです)。
② 鉄の工業的製法(高炉の仕組み)
鉄は自然界では「酸化鉄(赤鉄鉱や磁鉄鉱)」として存在します。ここから酸素を奪い取る(還元する)必要があります。
- ステップ1:高炉(こうろ)へ投入
- 上から:鉄鉱石($Fe_2O_3$など)、コークス(C)、石灰石($CaCO_3$)を入れます。
- 下から:熱風を吹き込みます。
- ステップ2:還元反応
- コークスが燃えて**一酸化炭素(CO)**が発生し、これが鉄鉱石から酸素を奪います。
$$Fe_2O_3 + 3CO \longrightarrow 2Fe + 3CO_2$$ - ステップ3:スラグの除去
- 石灰石は、鉄鉱石に含まれる不純物(泥や砂など)を溶かして**スラグ(ケイ酸カルシウム $CaSiO_3$)**として分離する役目があります。
③ 「銑鉄(せんてつ)」と「鋼(こう)」
高炉から出てきたばかりの鉄と、製品になる鉄は違います。**「炭素の量」**が決め手です。
- 銑鉄(せんてつ): 高炉から出てきたドロドロの鉄。
- 炭素を多く含み(約4%)、硬いがもろい(叩くと割れる)。
- 鋼(こう): 銑鉄を「転炉」に移し、酸素を吹き込んで炭素を燃やして減らしたもの。
- 炭素が少なく(0.02〜2%)、粘り強くて弾力がある(加工しやすい)。
2. 銅(Cu)・銀(Ag)・金(Au):オリンピックのメダル金属(p.273)
これらは11族の元素で、昔から硬貨や装飾品に使われてきました。
① 性質比べ
- 電気・熱の伝導性:
- Ag > Cu > Au の順でよく通します。銀がNo.1です。
- 展性・延性(伸びやすさ):
- Au がNo.1です(金箔のように極限まで薄くできます)。
② 化学的性質
- 酸への溶解:
- イオン化傾向が水素より小さいので、塩酸や希硫酸には溶けません。
- 硝酸や熱濃硫酸のような「酸化力のある酸」には溶けます。
- ※金($Au$)だけは最強なので、硝酸にも溶けず、王水にだけ溶けます。
- 不動態:
- 鉄($Fe$)、ニッケル($Ni$)、アルミニウム($Al$)は濃硝酸で不動態になりますが、銅や銀は不動態になりません(濃硝酸に激しく溶けます)。ここを混同しないように注意!
3. 合金(ごうきん):金属のブレンド(p.274)
2種類以上の金属を溶かし合わせたものを合金といいます。
特に銅の合金(黄銅・青銅・白銅)は、成分を問われる問題が頻出です。
① 銅の合金(絶対に覚える!)
| 名前 | 別名 | 成分 | 覚え方のイメージ | 用途 |
| 黄銅 | 真鍮(しんちゅう) | Cu + Zn (亜鉛) | 「美しくあえ(亜鉛)で」 | 5円玉、楽器(トランペット等) |
| 青銅 | ブロンズ | Cu + Sn (スズ) | 「青いスズ(スズ)」 | 10円玉、銅像、鐘 |
| 白銅 | - | Cu + Ni (ニッケル) | - | 50円玉、100円玉 |
② その他の重要合金
- ステンレス鋼: Fe + Cr + Ni (鉄・クロム・ニッケル)
- さびにくい(クロムが不動態の膜を作るため)。台所のシンクなど。
- ジュラルミン: Al + Cu + Mg など
- アルミニウムが主成分。軽くて強いので航空機の機体に使われます(※教科書p.274の表にはありませんが、入試では重要です)。
- はんだ: Pb + Sn (鉛・スズ)
- 融点が低いので、金属の接着に使われます。
- ニクロム: Ni + Cr
- 電気抵抗が大きいので、電熱線(ヒーター)に使われます。
全体の総まとめ:遷移元素のポイント
- 遷移元素の特徴: すべて金属、有色イオン、錯イオンを作る。
- 鉄の製造:
- 高炉で還元:$Fe_2O_3 + 3CO \to 2Fe + 3CO_2$
- 銑鉄(硬くてもろい) $\to$ 鋼(粘り強い)。
- 銅の合金(最重要):
- 黄銅(ブラス)= Cu + Zn
- 青銅(ブロンズ)= Cu + Sn
カラフルな遷移元素たち
1. クロム(Cr):カメレオンのような変色(p.275)
クロムの化合物は、酸性か塩基性かによって色がコロコロ変わるのが特徴です。
① 2つのイオンと色の変化
この2つのイオンの関係は絶対に覚えましょう。
- クロム酸イオン ($CrO_4^{2-}$): 黄色
- 塩基性の水溶液中で安定です。
- 二クロム酸イオン ($Cr_2O_7^{2-}$): 赤橙色(オレンジ色)
- 酸性の水溶液中で安定です。
反応式(平衡):
$$2CrO_4^{2-} (\text{黄}) + 2H^+ \rightleftharpoons Cr_2O_7^{2-} (\text{赤橙}) + H_2O$$
- 酸($H^+$)を加えると右(オレンジ)へ、塩基($OH^-$)を加えると左(黄色)へ移動します。
② 黄色い沈殿・赤い沈殿
クロム酸イオン(黄色)は、特定の金属と出会うと沈殿を作ります。
- $Ba^{2+}$(バリウム): $BaCrO_4$ $\longrightarrow$ 黄色沈殿
- $Pb^{2+}$(鉛): $PbCrO_4$ $\longrightarrow$ 黄色沈殿
- $Ag^+$(銀): $Ag_2CrO_4$ $\longrightarrow$ 赤褐色沈殿
2. マンガン(Mn):最強の酸化剤(p.275-276)
マンガンで覚えるべき物質は2つだけです。
① 過マンガン酸カリウム ($KMnO_4$)
- 色: 赤紫色(濃い紫)の結晶・水溶液。
- 役割: 強力な酸化剤として使われます。
- 色の変化(重要):
- 相手を酸化して自分は還元されると、マンガンイオン ($Mn^{2+}$) になります。
- $Mn^{2+}$ は**ほぼ無色(淡桃色)なので、反応が終わると「赤紫 $\to$ 無色」**に変化します。これが反応の終了サインとして使われます(酸化還元滴定)。
② 酸化マンガン(IV) ($MnO_2$)
- 色: 黒色の粉末。
- 役割:
- 触媒: 過酸化水素水から酸素を作るときなどに使いましたね。
- 酸化剤: 電池(マンガン乾電池)の中で使われます。
3. 鉄(Fe):2つの顔を持つ金属(p.276)
鉄イオンには、$Fe^{2+}$(2価)と $Fe^{3+}$(3価)の2種類があります。
この2つを見分ける**「検出反応」の表は、無機化学の最重要暗記項目**です!
① 基本カラー
- $Fe^{2+}$(鉄(II)イオン): 淡緑色
- $Fe^{3+}$(鉄(III)イオン): 黄褐色
② 検出反応マトリックス(表で覚える!)
試薬を加えたときに、どんな色になるか整理しましょう。
| 加える試薬 | Fe2+(淡緑色) | Fe3+(黄褐色) |
| 塩基 ($NaOH, NH_3$) | 緑白色沈殿
$Fe(OH)_2$ | 赤褐色沈殿
$Fe(OH)_3$ |
ヘキサシアノ鉄(III)酸K
$K_3[Fe(CN)_6]$ | 濃青色沈殿
(ターンブル青) | 褐色溶液
(変化なし) |
ヘキサシアノ鉄(II)酸K
$K_4[Fe(CN)_6]$ | 青白色沈殿 | 濃青色沈殿
(ベルリン青/プルシアンブルー) |
チオシアン酸K
$KSCN$ | 変化なし | 血赤色溶液
(真っ赤!) |
覚え方のコツ:
- 濃青色(濃い青)になるのは「数字が違うとき」
- $Fe^{2+}$(2価) + (III)酸カリウム $\to$ 青!
- $Fe^{3+}$(3価) + (II)酸カリウム $\to$ 青!
- 真っ赤(血赤色)になるのは $Fe^{3+}$ だけ
- 映画の血糊(ちのり)のような色です。
まとめ
- クロムの変色:
- 酸性 $\to$ 二クロム酸イオン(オレンジ)
- 塩基性 $\to$ クロム酸イオン(黄)
- マンガンの変色:
- 過マンガン酸カリウム(赤紫) $\to$ $Mn^{2+}$(無色)
- 鉄の検出(青色):
- $Fe^{2+}$ には (III)酸カリウム。
- $Fe^{3+}$ には (II)酸カリウム。
- 鉄の検出(赤色):
- $Fe^{3+}$ + チオシアン酸カリウム($KSCN$)。
銅の青と銀の光
1. 銅(Cu):青色の変化を見逃すな!(p.277)
銅イオン($Cu^{2+}$)を含む水溶液は、きれいな青色をしています。ここに塩基を加えると、劇的な変化が起こります。
① 2段階の変色反応(超重要)
この実験の流れは、ストーリーとして暗記しましょう。
- スタート: $Cu^{2+}$ の水溶液(青色)。
- アンモニア水(または$NaOH$)を「少量」加える:
- 青白色(白っぽい青)の沈殿ができる。
- 正体:水酸化銅(II) $Cu(OH)_2$
$$Cu^{2+} + 2OH^- \longrightarrow Cu(OH)_2$$
- アンモニア水を「過剰に(ドバドバ)」加える:
- 沈殿が溶けて、深青色(濃いインクのような青)の透明な溶液になる!
- 正体:テトラアンミン銅(II)イオン $[Cu(NH_3)_4]^{2+}$
$$Cu(OH)_2 + 4NH_3 \longrightarrow [Cu(NH_3)_4]^{2+} + 2OH^-$$
注意!
過剰に加えて溶けるのは「アンモニア」のときだけです。$NaOH$を過剰に加えても溶けません(両性元素ではないからです)。
② 銅の酸化物(色の違い)
銅を焼くと黒くなりますが、条件によって色が違います。
- 酸化銅(II) ($CuO$): 黒色。普通に加熱するとできる。
- 酸化銅(I) ($Cu_2O$): 赤色。フェーリング反応などでできる。
- 「$O$が1個($CuO$)なら黒、$Cu$が2個($Cu_2O$)なら赤」と区別しましょう。
2. 銀(Ag):沈殿と写真の化学(p.278)
銀イオン($Ag^+$)は無色ですが、いろいろなものと反応して沈殿を作ります。
① 褐色の沈殿(ひっかけポイント)
銀イオンに塩基($NaOH$など)を加えると、本来なら「水酸化銀($AgOH$)」ができそうですが、これは不安定すぎてすぐに水が抜けてしまいます。
結果として、酸化銀 ($Ag_2O$) の褐色沈殿ができます。
$$2Ag^+ + 2OH^- \longrightarrow Ag_2O (\text{褐色}) + H_2O$$
その後: ここにアンモニア水を過剰に加えると、無色の錯イオン(ジアンミン銀(I)イオン $[Ag(NH_3)_2]^+$)となって溶けます。
② ハロゲン化銀のグラデーション
第3章(ハロゲン)でもやりましたが、復習です。銀とハロゲンがくっつくと、色がだんだん濃くなります。
- $AgF$: 水に溶ける(沈殿しない)。
- $AgCl$: 白色沈殿。
- $AgBr$: 淡黄色(うすい黄色)沈殿。
- $AgI$: 黄色沈殿。
③ 写真の原理(感光性)
ハロゲン化銀(特に$AgBr$)に光が当たると、分解して**銀($Ag$)が析出します。
$$2AgBr \longrightarrow 2Ag + Br_2$$
この銀の粒子が黒く残ることで、映像が記録されます。これを「感光性(かんこうせい)」**といいます。
3. 鉄・銅・銀の反応まとめ(p.277)
最後に、これまで出てきた遷移元素のイオン反応を整理した表(p.277 表の下)を確認しましょう。
「アンモニア水を過剰に入れたとき」の反応が最大の識別ポイントです。
| 金属イオン | 少量のアンモニア | 過剰のアンモニア |
| $Fe^{2+}$ (淡緑) | 緑白色沈殿 | 溶けない |
| $Fe^{3+}$ (黄褐) | 赤褐色沈殿 | 溶けない |
| $Cu^{2+}$ (青) | 青白色沈殿 | 深青色溶液に溶ける |
| $Ag^{+}$ (無色) | 褐色沈殿 | 無色溶液に溶ける |
全体の総まとめ:無機化学完走!
これで、遷移元素の化合物まで含めた解説はすべて完了です。
今回のポイント:
- 銅のアンモニア反応: 青色沈殿 $\to$ 深青色溶液(テトラアンミン銅イオン)。
- 銀の塩基反応: 水酸化物ではなく**酸化銀(褐色)**が沈殿する。
- 銀のアンモニア反応: 無色の錯イオンになって溶ける。
- 写真の原理: ハロゲン化銀が光で分解して銀が出る(感光性)。
金属探偵の「7つ道具」
金属イオンを分離するためには、「この金属は、この薬品を入れると沈殿する(固まる)」というルールを頭に入れておく必要があります。
教科書p.279の表24が**「最強のカンニングペーパー」**です。これを以下のグループごとに整理して覚えましょう。
1. 塩化物イオン ($Cl^-$) で捕まえる(p.279)
希塩酸($HCl$)を加えたとき、沈殿するのは2つだけです。
- 銀 ($Ag^+$) $\longrightarrow$ $AgCl$ (白色沈殿)
- 鉛 ($Pb^{2+}$) $\longrightarrow$ $PbCl_2$ (白色沈殿)
- 重要: $PbCl_2$ は熱湯に溶けるという弱点があります。これを使って銀と鉛を分けます。
2. 硫化物イオン ($S^{2-}$) で捕まえる(p.280)
硫化水素($H_2S$)ガスを通すときは、**「液性が酸性か塩基性か」**で捕まえられる相手が変わります。これが最大の難所です。
① 酸性でも沈殿する(イオン化傾向が小さい金属)
イオン化傾向が小さい金属は、硫黄との結びつきが強いため、酸性条件($S^{2-}$が少ない状態)でも沈殿します。
- メンバー: $Ag, Pb, Cu, Hg, Sn$ など。
- 色: 黒色が多い($Ag_2S, PbS, CuS$ など)。
- 例外:$CdS$(カドミウム)は黄色、$SnS$(スズ)は褐色。
② 塩基性(中性)でないと沈殿しない(イオン化傾向が中くらいの金属)
イオン化傾向が少し大きい金属は、酸性では溶けたままで、中性〜塩基性にして初めて沈殿します。
- メンバー: $Zn, Fe, Ni, Mn$。
- 色(重要):
- $ZnS$:白色(硫化物で白は亜鉛だけ!)
- $FeS$:黒色
- $MnS$:淡桃色(ピンク)
理屈(コラム):
酸性条件では $H^+$ が多いため、$H_2S \rightleftharpoons 2H^+ + S^{2-}$ の平衡が左に寄り、$S^{2-}$ の濃度が極端に低くなります。そのため、よほど沈殿しやすい(溶解度積が小さい)金属しか沈殿できないのです。
3. 水酸化物イオン ($OH^-$) で捕まえる(p.280)
塩基($NaOH$や$NH_3$)を加えると、ほとんどの金属は水酸化物になって沈殿しますが、**「入れすぎると溶ける」**やつらがいましたね。
① 過剰の $NaOH$ に溶ける(両性元素)
- メンバー: $Al, Zn, Sn, Pb$ (ああすんなり)。
- これらは錯イオンを作って再び溶けます。
② 過剰の $NH_3$ に溶ける
- メンバー: $Ag, Cu, Zn$ (銀・銅・亜鉛)。
- これらもアンミン錯イオンを作って溶けます。
③ 沈殿の色(再確認)
- $Ag_2O$:褐色
- $Cu(OH)_2$:青白色
- $Fe(OH)_2$:緑白色 $\to$ $Fe(OH)_3$:赤褐色
- その他($Al, Zn, Pb$など):白色
4. その他の試薬(p.279 表24)
- 硫酸イオン ($SO_4^{2-}$): $Ba, Ca, Pb$ が白色沈殿します(「バカにするな硫酸」と覚えます)。
- クロム酸イオン ($CrO_4^{2-}$): $Ba, Pb$ が黄色沈殿します($Ag$は赤褐色)。
まとめ:沈殿ルール
この表が頭に入っていれば、謎解きは簡単です。
- 酸性で $H_2S$ 沈殿: $Cu, Pb, Ag$ など(黒)。
- 塩基性で $H_2S$ 沈殿: $Zn$(白)、$Fe$(黒)など。
- $HCl$ で沈殿: $Ag, Pb$(白)。
- $PbCl_2$ は熱湯に溶ける。
- $NaOH$ 過剰で溶解: $Al, Zn, Pb$。
- $NH_3$ 過剰で溶解: $Ag, Cu, Zn$。
謎解き!金属イオン分離の全手順
今回のミッション:
混合水溶液に入っている $Ag^+, Pb^{2+}, Cu^{2+}, Fe^{3+}, Zn^{2+}, Ba^{2+}$ の6人を、順番に一人ずつ捕まえて分離せよ。
第1関門:塩酸 ($HCl$) で捕まえる(p.281, 282)
まず、希塩酸を加えます。ここで脱落するのは「沈殿ルール1」のメンバーです。
- 沈殿: $AgCl$(白)、$PbCl_2$(白)
- 通過(ろ液): $Cu^{2+}, Fe^{3+}, Zn^{2+}, Ba^{2+}$
★ここでの識別ポイント(操作②)
白い沈殿が2つ混ざってしまいました。どうやって分ける?
$\longrightarrow$ **「熱湯」**を注ぎます!
- $PbCl_2$: 熱湯に溶ける $\longrightarrow$ ろ液の方へ行き、クロム酸カリウム($K_2CrO_4$)を加えると**黄色沈殿($PbCrO_4$)**が生じて確認完了。
- $AgCl$: 溶けない $\longrightarrow$ 残った沈殿にアンモニア水を加えると、錯イオンとなって溶けることで確認完了。
第2関門:酸性で硫化水素 ($H_2S$) で捕まえる(p.281, 282)
酸性のまま、硫化水素を通じます。ここで捕まるのは「イオン化傾向が小さい」メンバーです。
- 沈殿: $CuS$(黒)
- 通過(ろ液): $Fe^{2+}, Zn^{2+}, Ba^{2+}$
- ※ここで注意! 元々$Fe^{3+}$だった鉄イオンは、$H_2S$の還元作用によって $Fe^{2+}$(淡緑色) に変化しています。
★ここでの確認(操作③)
- 黒い沈殿($CuS$)を硝酸で溶かし、アンモニア水を過剰に加えると、深青色溶液になれば銅の確定です。
第3関門:煮沸・酸化してアンモニアを加える(p.281, 282)
ここが一番の手順の山場です。3つの操作を連続で行います。
- 煮沸する: 邪魔な$H_2S$ガスを追い出すため。
- 硝酸を加える: $Fe^{2+}$ を $Fe^{3+}$ に戻す(酸化する)ため(※$Fe(OH)_3$の方が沈殿しやすいから)。
- アンモニア水を過剰に加える: 塩基性にするため。
- 沈殿: $Fe(OH)_3$(赤褐色)
- これが鉄の正体です。
- 通過(ろ液): $Zn^{2+}, Ba^{2+}$
- なぜ亜鉛は沈殿しない?
- 亜鉛($Zn$)は両性元素かつアンモニアと錯イオンを作るので、過剰のアンモニア水には $[Zn(NH_3)_4]^{2+}$ となって溶けてしまうからです。ここが最大のひっかけポイントです!
第4関門:塩基性で硫化水素 ($H_2S$) で捕まえる(p.281, 282)
塩基性になった液に、再び硫化水素を通じます。
- 沈殿: $ZnS$(白)
- 硫化物なのに白い、あの亜鉛がついにここで捕まります。
- 通過(ろ液): $Ba^{2+}$
第5関門:炭酸アンモニウムで捕まえる(p.281, 282)
最後に残ったバリウムなどを捕まえます。炭酸アンモニウム $(NH_4)_2CO_3$ を加えます。
- 沈殿: $BaCO_3$(白)
- アルカリ土類金属(Ca, Sr, Ba)は炭酸塩となって沈殿します。
- 確認: 炎色反応を行うと、バリウム特有の黄緑色が見られます。
最後の残り:ろ液の中にいるのは?(p.282)
最後まで沈殿せずに生き残ったろ液には、ナトリウムイオン($Na^+$) や カリウムイオン($K^+$) が含まれている可能性があります。
これらは、炎色反応(Na:黄、K:赤紫)で確認します。
全体の総まとめ:分離の流れを一言で
- 酸・$H_2S$ $\to$ 銅($CuS$)が黒沈殿。
- アンモニア過剰 $\to$ 鉄($Fe(OH)_3$)が赤褐沈殿。(亜鉛は錯イオンで逃げる!)
- 塩基・$H_2S$ $\to$ 亜鉛($ZnS$)が白沈殿。
- 炭酸塩 $\to$ バリウム($BaCO_3$)が白沈殿。