【6章】化学反応と熱エネルギーの基本
最終更新日: 2026-01-10 21:37:50
作成者: カリスマ講師
化学反応と熱エネルギーの基本
はじめに:化学反応は「物質」だけでなく「熱」も変わる!
これまで化学といえば、「物質Aと物質Bがくっついて物質Cになる」という物質の変化ばかりを見てきました。しかし、現実の世界では、化学反応が起きるときには必ず**「熱の出入り」**がセットで起こります。
この章では、物質の変化と一緒に起こる**「エネルギー(熱)のやり取り」**に注目していきます。
1. 「温かくなる」か「冷たくなる」か?(発熱と吸熱)
反応が起きたとき、周りの温度がどうなるかで、反応は大きく2つに分けられます。
① 発熱反応(はつねつはんのう)
- イメージ: たき火、カイロ
- 現象: 反応すると熱が発生し、周りが温かくなる。
- 解説: 物質が持っていたエネルギーを外に放出する反応です。「余ったエネルギーを熱として捨てた」と考えると分かりやすいです。
- 例:木が燃える、濃硫酸を水に溶かす。
② 吸熱反応(きゅうねつはんのう)
- イメージ: 急速冷却パック
- 現象: 反応すると熱を吸収し、周りが冷たくなる。
- 解説: 周囲の熱エネルギーを奪い取って反応が進むタイプです。
- 例:硝酸カリウムを水に溶かす。
2. 「反応熱」ってなに?
化学反応に伴って出入りする熱の量のことを**「反応熱」と呼びます。
これには大事な3つのルール**があります。
- 主役は「1mol(モル)」:
「この物質 1mol が反応したとき、何kJ(キロジュール)の熱が出るか(吸うか)」で表します。
- 単位は $kJ/mol$ です。
- 条件:
温度や圧力で熱量は変わるため、通常は $25^\circ C$、1気圧 の状態を基準にします。 - プラスとマイナス(重要!):
- 発熱(熱が出る) = 正の値(+)
- 吸熱(熱を吸う) = 負の値(-)
※後の「熱化学方程式」で非常に重要になります。
3. 代表的な4つの反応熱
反応の種類によって名前がついていますが、全部覚える必要はありません。「何をした時の熱か」を理解しましょう。
| 熱の種類 | 定義(主役 1mol がどうなる時?) | 特徴 |
| 燃焼熱 | 物質が酸素と反応して燃えるとき | 必ず発熱します(燃えて冷える火はありません)。 |
| 生成熱 | 成分元素の単体から化合物ができるとき | 発熱も吸熱もあります。 |
| 中和熱 | 酸と塩基が反応して水 1mol ができるとき | 必ず発熱します。 |
| 溶解熱 | 物質が大量の溶媒(水など)に溶けるとき | 発熱(硫酸など)も吸熱(硝酸カリウムなど)もあります。 |
ポイント: 「中和熱」の定義は「水 ($H_2O$) が 1mol できるとき」です。酸や塩基の量ではない点に注意しましょう。
4. なぜ熱が出たり入ったりするの?(エネルギー図の理解)
ここが一番の「なるほど!」ポイントです。
すべての物質は、それぞれの状態に応じた**「エネルギー(熱含量・エンタルピー)」**を内部に持っています。これを「お財布の中身」に例えてみましょう。
A. 発熱反応のしくみ(エネルギーが高い→低い)
- 反応前(反応物): エネルギーをたくさん持っている(お金持ち)。
- 反応後(生成物): エネルギーが少ない(貧乏)。
- 結果: 持っていたエネルギーが余るので、その差額を外に放出します。これが「発熱」です。
- 図のイメージ:高い場所から低い場所へボールが落ちる時、エネルギーが放出される感じ。
B. 吸熱反応のしくみ(エネルギーが低い→高い)
- 反応前(反応物): エネルギーが少ない。
- 反応後(生成物): エネルギーをたくさん持っている状態になりたい。
- 結果: 足りないエネルギーを周りから吸収して補充します。これが「吸熱」です。
- 図のイメージ:低い場所から高い場所へ上がるには、外部からエネルギーをもらう必要がある感じ。
5. どうやって測るの?
「断熱容器(熱が逃げない入れ物)」を使って実験します。
- ボンベ熱量計: 頑丈な容器の中で燃焼させ、周りの水の温度上昇を測る方法。
- 簡易熱量計: 発泡ポリスチレンや魔法瓶などで熱を遮断し、温度計と攪拌(かくはん)棒を入れて反応させる方法。
原理:
「水の温度が $X^\circ C$ 上がった」ということは「水が得た熱量 = 物質が放出した熱量」と考えて計算します。
「熱化学」の言葉の意味と、「なぜ熱が出るのか(エネルギーの差)」というイメージを持てれば、このパートは完璧です。
熱化学方程式の完全攻略
1. 「熱化学方程式」ってなに?
普通の化学反応式に、「熱の出入り」の情報を書き加えた式のことです。
化学反応式が「物質の変化」を表すレシピなら、熱化学方程式は**「物質 + エネルギーの収支」を表す家計簿**のようなものです。
最大の特徴:矢印(→)ではなく等号(=)を使う!
これが一番の違いです。「左辺(反応前の物質のエネルギー)」と「右辺(反応後の物質のエネルギー + 出入りした熱)」が**等しい(釣り合っている)**という意味で = で結びます。
2. 絶対に守るべき「5つの鉄則」
教科書の内容を整理すると、以下の5つのルールに集約されます。これさえ守れば間違えません。
鉄則①:矢印 → をやめて = にする
- × $2H_2 + O_2 \rightarrow 2H_2O$
- ○ $2H_2 + O_2 = 2H_2O$ ...(まだ途中)
鉄則②:右辺に熱量を書く(符号に注意!)
ここが最重要です。
- 発熱反応(熱が出る):プラス $(+)$ で書く
- 式:反応物 = 生成物 $+ Q \text{kJ}$
- 意味:「反応したら生成物ができて、さらに $Q \text{kJ}$ の熱が余って外に出た」
- 吸熱反応(熱を吸う):マイナス $(-)$ で書く
- 式:反応物 = 生成物 $- Q \text{kJ}$
- 意味:「反応物から $Q \text{kJ}$ 引かないと(吸わせないと)、生成物になれない」
鉄則③:物質の状態 (固)(液)(気) を必ず書く
同じ物質でも、状態(氷か水か水蒸気か)によって持っているエネルギーが違うからです。
- 例:水蒸気(気体)は、水(液体)よりもエネルギーが高いので、反応熱の値が変わってしまいます。
- 表記:$H_2O(液)$ や $H_2O(気)$、$C(黒鉛)$ などと明記します。
- ※明らかにわかる場合($O_2$など)は省略することもありますが、慣れるまでは書くのが無難です。
鉄則④:係数は「分数」でもOK!
普通の化学反応式では「係数は最も簡単な整数比」でしたが、熱化学方程式では**「主役の物質 1mol」**を基準にします。
- だから、$H_2 + \frac{1}{2}O_2 = H_2O(液) + 286\text{kJ}$ のように、分数($1/2$)が登場してもOKです。
鉄則⑤:化学式の後ろに aq をつけると「大量の水」
物質を水に溶かす反応(溶解)を表すとき、水($H_2O$)を大量に使うことを aq (アクア)という記号で表します。
- 例:$NaOH(固) + aq = NaOHaq + 44.5\text{kJ}$
- 意味:固体の水酸化ナトリウムを大量の水(aq)に溶かすと、水溶液(NaOHaq)になって発熱する。
3. 実際の式の作り方(ステップ解説)
教科書の例題(水素が燃えて液体の水ができる:発熱286kJ)を使って、式を作ってみましょう。
- まず普通の化学反応式を書く
$$2H_2 + O_2 \rightarrow 2H_2O$$ - 主役(水素)を 1mol に合わせる
全体を2で割ります。
$$H_2 + \frac{1}{2}O_2 \rightarrow H_2O$$ - 状態を書き、矢印を=にする
$$H_2(気) + \frac{1}{2}O_2(気) = H_2O(液)$$ - 熱量を付け足す(発熱なら+、吸熱なら-)
$$H_2(気) + \frac{1}{2}O_2(気) = H_2O(液) + 286\text{kJ}$$
これで完成です!
4. 化学反応式 vs 熱化学方程式
混同しやすい2つの違いを表にまとめました。
| 化学反応式 | 熱化学方程式 | |
| つなぐ記号 | 矢印 ($\rightarrow$) | 等号 ($=$) |
| 係数の意味 | 反応する「個数」や「モル」の比 | 反応する**「モル(mol)」そのもの** |
| 係数のルール | 原則、整数のみ | 分数もOK (主役を1にするため) |
| 状態の記述 | 書かないことが多い | 必須 (固・液・気) |
| 熱の記述 | 書かない | 右辺に $\pm \dots \text{kJ}$ を書く |
5. 解くときのコツ(教科書 p.143 例題より)
問題を解くときは、「何が 1mol なのか?」(=反応の主役は誰か?)に注目してください。
- 燃焼熱と言われたら? → 燃える物質を 1mol にする。
- 例:「メタンの燃焼熱」→ メタン($CH_4$)の係数を1にする。
- 生成熱と言われたら? → **できる物質(生成物)**を 1mol にする。
- 例:「アンモニアの生成熱」→ アンモニア($NH_3$)の係数を1にする(材料の $N_2$ や $H_2$ は分数になっても構わない)。
まとめ:この章でできるようになるべきこと
- 用語の理解: 「発熱」「吸熱」の違いがわかる。
- 式のルール: 「=を使う」「状態を書く」「発熱は+、吸熱は-」を守れる。
式の作成: 文章(「〜の燃焼熱は〇〇kJである」)から、正しい熱化学方程式が書ける。
ヘスの法則と計算の魔法
1. ヘスの法則(総熱量保存の法則)とは?
山登りをイメージしてください。「麓(ふもと)」から「山頂」へ行くとき、まっすぐ登っても、くねくね道を登っても、ロープウェーを使っても、**「高さの変化」**は同じですよね?
化学反応のエネルギーもこれと同じです。
- 法則: 「反応の始めの状態(反応物)」と「終わりの状態(生成物)」が決まっていれば、途中でどんなルート(経路)を通っても、出入りする熱量の合計(総和)は等しい。
- 別名: 総熱量保存の法則
- 発見者: ヘスさん(スイスの化学者、1840年)
具体例:水ができるとき
水素と酸素から「液体の水」ができるまでには、2つのルートがあります。
- 直接ルート: 水素と酸素が反応して、いきなり「水(液体)」になる(発熱 $286\text{kJ}$)。
- 寄り道ルート: 一旦「水蒸気(気体)」になって(発熱 $242\text{kJ}$)、そこから冷えて「水(液体)」になる(発熱 $44\text{kJ}$)。
ヘスの法則通り、$242 + 44 = 286$ となり、どちらのルートでも合計の熱量は同じになります。
2. ヘスの法則の実験(証明)
教科書では、「固体の水酸化ナトリウム($NaOH$)」と「塩酸($HCl$)」を反応させる実験でこれを確かめています。
- ルートA: 固体の $NaOH$ を、直接塩酸に溶かす。
- 結果:$Q_3$ の熱が出る。
- ルートB(2段階):
- まず、固体の $NaOH$ を水に溶かす(溶解熱 $Q_1$)。
- その水溶液を、塩酸と混ぜる(中和熱 $Q_2$)。
- 結果:合計で $Q_1 + Q_2$ の熱が出る。
実験の結果、$Q_3$ と $Q_1 + Q_2$ はほぼ等しくなることがわかります。つまり、一気に反応させても、段階を踏んでも、熱の合計は変わらないのです。
3. 【最重要】熱化学方程式の計算テクニック
ここがテストに出るポイントです!
ヘスの法則のおかげで、熱化学方程式は数学の連立方程式のように「足したり引いたり」して解くことができます。
手順:未知の熱化学方程式をつくる
「黒鉛($C$)と酸素から、一酸化炭素($CO$)ができる反応熱 $Q$」を知りたいとします。
しかし、実験で $C$ を燃やすと $CO$ を通り越して $CO_2$ になりやすいため、直接 $Q$ を測るのは難しいのです。そこで計算で求めます。
【使える式(ヒント)】
① $C + O_2 = CO_2 + 394\text{kJ}$ (Cの燃焼熱)
② $CO + \frac{1}{2}O_2 = CO_2 + 283\text{kJ}$ (COの燃焼熱)
【求めたい式(ゴール)】
③ $C + \frac{1}{2}O_2 = CO + Q\text{kJ}$
【解き方:消去法】
ゴールの式③には、$CO_2$ がありません。また、$CO$ は右辺にあります。
そこで、①式から②式を引き算して $CO_2$ を消します。
$$\begin{aligned} (C + O_2) - (CO + \frac{1}{2}O_2) &= (CO_2 + 394) - (CO_2 + 283) \\ C + \frac{1}{2}O_2 - CO &= 111 \\ C + \frac{1}{2}O_2 &= CO + 111\text{kJ} \end{aligned}$$
これで、$Q = 111\text{kJ}$ だとわかりました!
初心者のためのコツ
パズルだと思ってください。「ゴールの式にある物質」を残し、「ゴールの式にない物質」を消すように、式を足したり引いたりすればOKです。
第2部:結合エネルギーと反応熱
次に、「なぜ反応すると熱が出たり入ったりするの?」という理由を、原子レベルの**「結合」**から解説します。
1. 結合エネルギーとは?
原子と原子は、しっかりと手をつないで分子を作っています(共有結合)。この手を引きはがしてバラバラにするのに必要なエネルギーを「結合エネルギー」といいます。
- 結合を切る(バラバラにする): エネルギーが必要(吸熱 = マイナス)。
- イメージ:強力な磁石を引きはがすには力がいります。
- 結合ができる(くっつく): エネルギーが放出される(発熱 = プラス)。
- イメージ:磁石がパチンとくっつくとき、勢い(エネルギー)が出ます。
2. 結合エネルギーを使った計算方法
すべての反応は、**「①いまある結合を全部切ってバラバラにする」→「②新しい組み合わせで結合を作り直す」**と考えることができます。
公式(イメージ)
$$\text{反応熱} = (\text{あとでできる結合のエネルギー}) - (\text{最初に切る結合のエネルギー})$$
例題:アンモニアの生成熱
$N_2$ と $H_2$ から $NH_3$ を作ります。
- 材料をバラバラにする(エネルギーの支払い):
- $N \equiv N$ を1個切る(942kJ必要)
- $H-H$ を3個切る(432kJ × 3 必要)
- 合計コスト: $942 + 1296 = 2238\text{kJ}$
- 新しく組み立てる(エネルギーの受け取り):
- $N-H$ 結合を合計6個作る($NH_3$ は手が3本なので、2分子で6本)。
- $386\text{kJ} \times 6 = 2316\text{kJ}$
- 収支決算:
- (受け取り) - (支払い) = $2316 - 2238 = 78\text{kJ}$
式全体では $N_2 + 3H_2 = 2NH_3 + 78\text{kJ}$ となります。
アンモニア1molあたりの生成熱なら、これを2で割って $39\text{kJ/mol}$ となります。
全体のまとめ(次のステップへ)
- ヘスの法則: 反応熱はルートによらず一定である(スタートとゴールだけで決まる)。
- 熱化学方程式の計算: 式同士を足し引きして、未知の反応熱を求められる。
- 結合エネルギー: 「結合を切るエネルギー」と「結合ができるエネルギー」の差額が反応熱になる。
ここまでで「化学反応と熱」の章(第1章)は完了です!
酸と塩基の正体とは?
1. 「酸(さん)」と「塩基(えんき)」ってなに?
昔の人は、味や手触りでこれらを区別していました。
- 酸(Acid):
- 味:すっぱい(レモン、酢など)。
- リトマス紙:青 $\rightarrow$ 赤 に変える。
- 金属との反応:亜鉛や鉄を溶かして水素を出す。
- 塩基(Base): ※一般的にアルカリとも呼ばれます。
- 味:苦い。
- 手触り:ぬるぬるする(タンパク質を少し溶かすため)。
- リトマス紙:赤 $\rightarrow$ 青 に変える。
2. アレニウスの定義(水の中での話)
19世紀、スウェーデンの化学者アレニウスは、これらを「どのようなイオンを出すか」で科学的に定義しました。これが最も基本の定義です。
① アレニウスの酸
「水に溶けて、水素イオン ($H^+$) を出す物質」
- 例:塩酸 ($HCl$)
$$HCl \rightarrow H^+ + Cl^-$$
水の中で $H^+$ を放出していますね。これが酸っぱさの正体です。補足: 実際には $H^+$ は水分子とくっついて「オキソニウムイオン ($H_3O^+$)」として存在しますが、式を書くときは面倒なので単に $H^+$ と書くことが一般的です。
② アレニウスの塩基
「水に溶けて、水酸化物イオン ($OH^-$) を出す物質」
- 例:水酸化ナトリウム ($NaOH$)
$$NaOH \rightarrow Na^+ + OH^-$$
この $OH^-$ がアルカリ性の正体です。
【注意!】アンモニア($NH_3$)の謎
アンモニアの分子には $OH$ がありませんが、水に溶けると塩基になります。なぜでしょう?
- 理由:水 ($H_2O$) と反応して $OH^-$ を生み出すからです。
$$NH_3 + H_2O \rightleftharpoons NH_4^+ + OH^-$$
3. ブレンステッドの定義(もっと広い話)
アレニウスの定義には弱点がありました。「水に溶けない場合」や「水がない場所での反応」を説明できないのです。
そこでデンマークのブレンステッドは、定義を拡張しました。キーワードは**「キャッチボール」**です。
- 酸: 水素イオン ($H^+$) を相手に与える物質(投げ手)。
- 塩基: 水素イオン ($H^+$) を相手から受け取る物質(受け手)。
具体例:アンモニアと塩化水素の空中戦
水がない状態で、アンモニアガスと塩化水素ガスが反応して白煙(塩化アンモニウム)ができる反応を見てみましょう。
$$NH_3(気) + HCl(気) \rightleftharpoons NH_4^+ + Cl^-$$
- $HCl$ は、$H^+$ を相手に与えて $Cl^-$ になった $\rightarrow$ 酸
- $NH_3$ は、$H^+$ を受け取って $NH_4^+$ になった $\rightarrow$ 塩基
ポイント:
水 ($H_2O$) も、相手によって酸になったり塩基になったりします。
- $NH_3$ に対しては $H^+$ を与えるので「酸」。
- $HCl$ に対しては $H^+$ を受け取るので「塩基」として働きます。
4. ちょっと特殊なやつ:両性水酸化物
水酸化アルミニウム $Al(OH)_3$ のように、相手によって態度を変える「コウモリ」のような物質がいます。
- 相手が酸 ($HCl$) のとき $\rightarrow$ 自分は塩基として反応して中和する。
- 相手が強塩基 ($NaOH$) のとき $\rightarrow$ 自分は酸として反応して溶ける。
これを**「両性水酸化物」**といいます。
ここまでが「前半:定義」の解説です。
「$H^+$ を出すのが酸、$OH^-$ を出すのが塩基」という基本(アレニウス)を押さえつつ、「$H^+$ のキャッチボール」という広い定義(ブレンステッド)があることを理解できればOKです。
酸・塩基の「強さ」と「価数」
1. 「強い」酸と「弱い」酸の違い(電離度)
「酸が強い」というのは、単に濃度が濃いという意味ではありません。水に入れたとき、どれだけ張り切ってイオン($H^+$ や $OH^-$)を出すか、という「やる気」のことを指します。これを数値にしたのが**「電離度(でんりど)」**です。
電離度 $\alpha$(アルファ)のイメージ
100個の酸の分子を水に入れたと想像してください。
- 強酸(きょうさん): 100個中、ほぼ100個全員が $H^+$ を放出してイオンになる。
- 電離度 $\alpha \approx 1$ (1に近い)
- 例:塩酸、硝酸など。電気をすごくよく通します(豆電球が明るくつく)。
- 弱酸(じゃくさん): 100個中、1個くらいしか $H^+$ を出さない。残りの99個は分子のままじっとしている。
- 電離度 $\alpha \ll 1$ (1よりずっと小さい、0.01など)
- 例:酢酸(お酢)。電気は少ししか通りません(豆電球が暗い)。
計算公式
$$\text{電離度 } \alpha = \frac{\text{電離した物質量(mol)}}{\text{溶かした物質量(mol)}}$$
つまり、「溶かしたうちの何割がイオンになったか」という割合です。
2. 覚えておくべき代表選手(強・弱の分類)
テストでは「どれが強酸か?」がよく問われます。「強」のグループは数が少ないので、こちらを暗記して、それ以外は「弱」と判断するのがコツです。
| 分類 | 代表的な物質(ここを覚えよう!) | 特徴 |
| 強酸 | 塩酸($HCl$)、硝酸($HNO_3$)、硫酸($H_2SO_4$) | ほぼ100%電離する。危険な薬品が多い。 |
| 弱酸 | 酢酸($CH_3COOH$)、炭酸($H_2CO_3$)、硫化水素($H_2S$) | 一部しか電離しない。食品に含まれるものも多い。 |
| 強塩基 | 水酸化ナトリウム($NaOH$)、水酸化カリウム($KOH$)
水酸化カルシウム($Ca(OH)_2$)、水酸化バリウム($Ba(OH)_2$) | アルカリ金属・アルカリ土類金属の水酸化物。 |
| 弱塩基 | アンモニア($NH_3$) | 水酸化銅(II)など、沈殿するものもここに含まれる。 |
注意: 弱酸や弱塩基は「電離度が小さい」だけで、反応しないわけではありません。
3. 「価数(かすう)」とは?(強さとは別物!)
(教科書 p.157)
価数とは、1つの分子が最大で何個の $H^+$(または $OH^-$)を出せるかという「数」のことです。
- 1価: $H^+$ を1個出せる。(例:$HCl$, $HNO_3$, $CH_3COOH$)
- 2価: $H^+$ を2個出せる。(例:$H_2SO_4$, $H_2S$)
- 3価: $H^+$ を3個出せる。(例:$H_3PO_4$)
よくあるひっかけ問題
- 酢酸 ($CH_3COOH$) は何価?
- $H$ が4個ありますが、$H^+$ として出せるのは最後の1個だけです。だから**「1価」**です。
- アンモニア ($NH_3$) は何価?
- 水と反応して $OH^-$ を1個作るので**「1価」**の塩基として扱います。
重要: 「2価の酸だから強い」とは限りません。
- $H_2SO_4$(2価)は強酸ですが、$H_2CO_3$(2価)は弱酸です。
- 「価数」は武器の数、「強さ(電離度)」は武器を使うやる気、と区別しましょう。
4. 多段階電離(2回に分けて出す)
2価以上の酸($H_2SO_4$など)は、一度に全ての $H^+$ を放出するのではなく、段階を踏んで放出します。
- 第1段階: $H_2SO_4 \rightarrow H^+ + HSO_4^-$ (勢いよく出る)
- 第2段階: $HSO_4^- \rightleftharpoons H^+ + SO_4^{2-}$ (出にくい)
一般に、1個目を出すのは簡単ですが、2個目、3個目となるにつれて放出するのが難しくなり、電離度は小さくなります。
第2章「酸と塩基」前半まとめ
ここまでで、酸・塩基の基本スペックである「定義」「強弱(電離度)」「価数」を学びました。
- 定義: 水に溶けて $H^+$ を出すのが酸、$OH^-$ を出すのが塩基。
- 強弱: たくさんイオンになるのが「強」、サボるのが「弱」。
- 価数: 持っている $H^+$ や $OH^-$ の個数(強さとは無関係)。
これらは、次のステップである「中和反応」や「pH(ピーエイチ)の計算」の基礎となります。
「水」の秘密と「pH」の決まり
1. 水は「ただの水」ではない(水のイオン積)
純粋な水 ($H_2O$) は、電気を通さない絶縁体だと思われがちですが、実はごくわずかに「電離」しています。
5億個以上の水分子のうち、たった1個くらいの割合で、勝手にイオンに分かれています。
$$H_2O \rightleftharpoons H^+ + OH^-$$
黄金のルール:水のイオン積 $K_w$
ここで、化学Ⅱや入試までずっと使う「絶対のルール」が登場します。
温度が一定(25℃)なら、どんな水溶液(酸性でも塩基性でも)であっても、以下の掛け算の答えは常に一定になります。
$$[H^+] \times [OH^-] = 1.0 \times 10^{-14} \, (\text{mol/l})^2$$
- $[H^+]$: 水素イオンの濃度(酸の成分)
- $[OH^-]$: 水酸化物イオンの濃度(塩基の成分)
この一定の値 ($1.0 \times 10^{-14}$) を**「水のイオン積 ($K_w$)」**と呼びます。
シーソーの関係
このルールのおかげで、片方が増えれば、もう片方は必ず減ります。
- 酸を加えて $[H^+]$ が増える $\rightarrow$ 自動的に $[OH^-]$ は減る。
- 塩基を加えて $[OH^-]$ が増える $\rightarrow$ 自動的に $[H^+]$ は減る。
しかし、掛け算した答えは常に $10^{-14}$ をキープします。これがpH計算の土台です。
2. 酸性・中性・塩基性の基準
「中性」とは、酸と塩基の成分が互角の状態です。
- 中性: $[H^+] = [OH^-] = 1.0 \times 10^{-7}$
- ($10^{-7} \times 10^{-7} = 10^{-14}$ になっています)
- 酸性: $[H^+]$ の方が多い($1.0 \times 10^{-7}$ より大きい)。
- 塩基性: $[OH^-]$ の方が多い($[H^+]$ は $1.0 \times 10^{-7}$ より小さい)。
3. 「pH(ピーエイチ)」の登場
水素イオン濃度 $[H^+]$ は $0.0000001$ のように桁が多すぎて扱いづらいです。そこで、「$10$ の右肩にある数字(指数)」だけを取り出して表すことにしました。これが pH(水素イオン指数) です。
定義式(公式)
$$\text{pH} = -\log_{10} [H^+]$$
難しく見えますが、基本は**「$10$ の何乗か?」の「マイナスを取った数字」**だと考えればOKです。
- $[H^+] = 10^{-7}$ なら $\rightarrow$ $\text{pH} = 7$ (中性)
- $[H^+] = 10^{-2}$ なら $\rightarrow$ $\text{pH} = 2$ (酸性)
- $[H^+] = 10^{-13}$ なら $\rightarrow$ $\text{pH} = 13$ (塩基性)
【イメージ図】
数字の数直線で見ると、以下のようになります。
- pH 7: 中性
- pH 7より小さい (0〜6): 酸性(数字が小さいほど酸が濃い!)
- pH 7より大きい (8〜14): 塩基性
【後半】計算テクニックと測定方法
4. pHの計算パターン(ここがテストに出る!)
パターンA:酸のpHを求める(素直なパターン)
「$0.10 \text{mol/l}$ の酢酸(電離度 $0.013$)」のpHは?
- $[H^+]$ を出す:
濃度 $\times$ 電離度 $= 0.10 \times 0.013 = 1.3 \times 10^{-3} \text{mol/l}$ - 公式に入れる:
$\text{pH} = -\log(1.3 \times 10^{-3})$
$= 3 - \log 1.3$
(問題文に $\log 1.3 = 0.11$ とあるので)
$= 3 - 0.11 = 2.89$
パターンB:塩基のpHを求める(ワンクッション必要)
ここが最大のひっかけポイントです。 塩基(アンモニアなど)からは、直接 $[H^+]$ は出ません。$[OH^-]$ が出ます。
「$0.10 \text{mol/l}$ のアンモニア水(電離度 $0.013$)」のpHは?
- まず $[OH^-]$ を出す:
濃度 $\times$ 電離度 $= 0.10 \times 0.013 = 1.3 \times 10^{-3} \text{mol/l}$
これは $H^+$ ではありません! - 「水のイオン積」を使って $[H^+]$ に変換する:
$[H^+] = \frac{1.0 \times 10^{-14}}{[OH^-]} = \frac{1.0 \times 10^{-14}}{1.3 \times 10^{-3}} = \frac{1}{1.3} \times 10^{-11}$ - pHを計算する:
$\text{pH} = -\log(\frac{1}{1.3} \times 10^{-11}) \approx 11.1$
裏ワザ(p.163 参考):
$\text{pH} + \text{pOH} = 14$ という関係があります。
塩基の場合は、一旦 $\text{pOH}$($OH$バージョンの指数)を出して、14から引くと早いです。
5. 薄めたらどうなる?(希釈)
- 酸を薄める: 酸性が弱まるので、pHは7に近づく(増える)。
- 酸を10倍薄めると、pHは 1 増えます。
- 100倍薄めると、pHは 2 増えます。
- 塩基を薄める: 塩基性が弱まるので、pHは7に近づく(減る)。
- 塩基を10倍薄めると、pHは 1 減ります。
注意!
酸をいくら薄めても、決してアルカリ性(pH 8以上)にはなりません。限りなくpH 7に近づくだけです。
6. どうやって測る?(指示薬とpH計)
pHを目で見て知るために**「pH指示薬(しじやく)」**を使います。特定のpHを超えると色が変わる薬品です。
【必ず覚えるべき2つ】
- メチルオレンジ (MO):
- 変色域: pH 3.1〜4.4
- 色: 赤 $\rightarrow$ 黄
- 使い道: 酸性側での色の変化を見る。
- フェノールフタレイン (PP):
- 変色域: pH 8.0〜9.8
- 色: 無色 $\rightarrow$ 赤
- 使い道: 塩基性側での色の変化を見る。
これらは、次の「中和滴定(ちゅうわてきてい)」で、反応の終了を知る合図として使われます。
中和反応の「仕組み」と「計算」
1. 中和反応(ちゅうわはんのう)とは?
「酸」と「塩基」を混ぜると、お互いの性質を打ち消し合います。これを中和といいます。
主役は、酸の $H^+$ と、塩基の $OH^-$ です。
① 水ができる
酸と塩基が出会うと、必ず水 ($H_2O$) が生まれます。
$$H^+ + OH^- \rightarrow H_2O$$
これが中和の正体です。
② 「塩(えん)」ができる
主役の $H^+$ と $OH^-$ が水になって去ったあと、残されたイオン同士がくっついたものを**「塩(えん)」**と呼びます。
- 例:塩酸 ($HCl$) と水酸化ナトリウム ($NaOH$) を混ぜた場合
- $H^+$ と $OH^-$ $\rightarrow$ 水 ($H_2O$) になる。
- 残った $Na^+$ と $Cl^-$ $\rightarrow$ 塩化ナトリウム ($NaCl$) になる。これが「塩」です。
ポイント: 「塩(えん)」=「食塩」だけではありません。中和でできる物質の総称です(例:$Na_2SO_4$, $NH_4Cl$ など)。
2. 完全に中和する条件(量的関係)
ここから計算の話に入ります。
酸と塩基を「過不足なく(ぴったり)」中和させるには、どうすればよいでしょうか?
「同じ体積混ぜればいい」のではありません。**「$H^+$ と $OH^-$ の個数(モル)を同じにする」**ことが条件です。
「価数(かすう)」という罠に注意
図を見てください。
- 1価の酸 ($HCl$): 1分子から $H^+$ を 1個 出す。
- 2価の酸 ($H_2SO_4$): 1分子から $H^+$ を 2個 出す。
つまり、$H_2SO_4$ は $HCl$ の 2倍の戦力 を持っています。
したがって、1mol の硫酸 ($H_2SO_4$) を中和するには、1mol の $NaOH$ では足りず、2mol の $NaOH$ が必要になります。
3. 必殺の「中和の公式」
中和の計算問題は、すべて以下のたった1つの式で解けます。これを暗記してください。
$$酸のモル数 \times 価数 = 塩基のモル数 \times 価数$$
これを詳しい式(濃度と体積)に直すと、こうなります。
$$a \times c \times \frac{v}{1000} = b \times c' \times \frac{v'}{1000}$$
- 左辺(酸チーム):
- $a$: 酸の価数($HCl$なら1、$H_2SO_4$なら2)
- $c$: 酸の濃度 (mol/l)
- $v$: 酸の体積 (ml)
- 右辺(塩基チーム):
- $b$: 塩基の価数($NaOH$なら1、$Ca(OH)_2$なら2)
- $c'$: 塩基の濃度 (mol/l)
- $v'$: 塩基の体積 (ml)
コツ:
両辺とも体積が $\text{ml}$ なら、分母の $1000$ は省略して計算してもOKです(両辺を1000倍したと考えればよい)。
$$a \times c \times v = b \times c' \times v'$$
例題で確認
「$0.20 \text{mol/l}$ の塩酸 $30 \text{ml}$ を中和するのに必要な $NaOH$(式量40)は何gか?」
- 酸チームの $H^+$ の量:
$1(\text{価}) \times 0.20(\text{mol/l}) \times \frac{30}{1000}(\text{l}) = 0.006 \text{mol}$ - 塩基チームの $OH^-$ の量:
$NaOH$ の重さを $x$グラムとすると、モル数は $\frac{x}{40}$ mol。
$1(\text{価}) \times \frac{x}{40}$ - イコールで結ぶ:
$0.006 = \frac{x}{40}$
$x = 0.24 \text{g}$
4. 複数の酸・塩基が混ざったら?
「塩酸と硫酸の混合液」のように、酸や塩基が複数種類あっても考え方は同じです。
**「酸チーム全員が出す $H^+$ の合計」と「塩基チーム全員が出す $OH^-$ の合計」**が釣り合えばOKです。
$$\text{(酸Aの} H^+ \text{)} + \text{(酸Bの} H^+ \text{)} = \text{(塩基Cの} OH^- \text{)} + \dots$$
教科書の例題(p.169)のように、複数の物質が登場しても、一つずつ足し算していけば解くことができます。
ここまでが「中和の理論と計算」です。
「$acv = bc'v'$」の公式さえ使いこなせれば、中和の計算は怖くありません。
中和滴定と滴定曲線
1. 中和滴定(ちゅうわてきてい)とは?
濃度がわからない酸(または塩基)があるとき、濃度がわかっている塩基(または酸)を使って、正確な濃度を突き止める実験のことを「中和滴定」といいます。
- 標準溶液: 濃度が正確にわかっている溶液のこと(これを基準にします)。
実験の手順(イメージ)
- 濃度を知りたい「酸」をコップ(コニカルビーカー)に入れます。
- そこに「pH指示薬(色がかわる薬)」を数滴入れます。
- 上から「標準溶液(塩基)」をポタッ、ポタッと少しずつ垂らしていきます。
- コップの中の色が**「パッ」と変わった瞬間**が、中和完了の合図(中和点)です。
- そのときまでに使った塩基の量を測れば、計算($acv = bc'v'$)で酸の濃度がわかります。
2. 実験に使う道具(名前と形を覚えよう!)
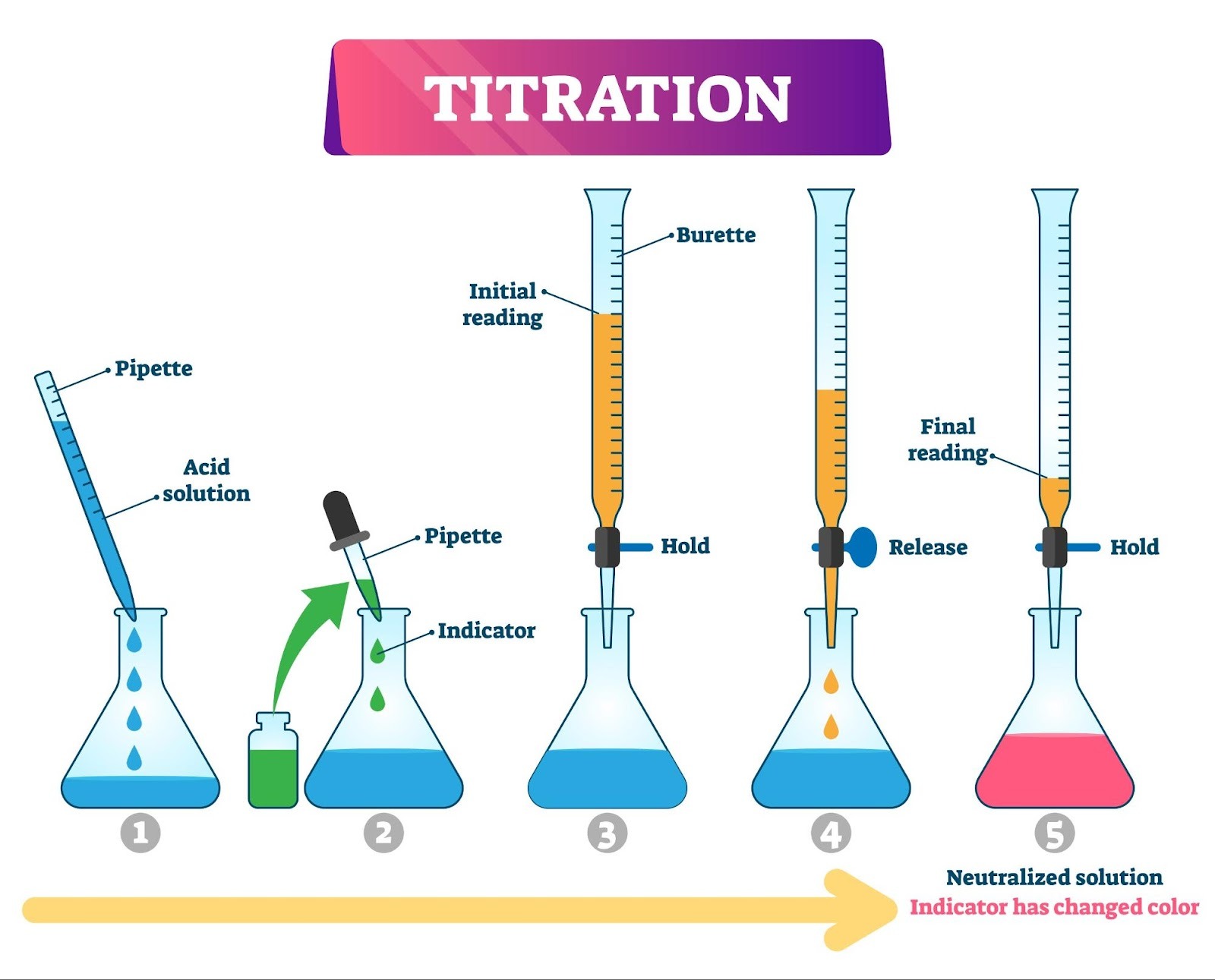
Shutterstock
この実験は「正確さ」が命なので、専用のガラス器具を使います。
- ホールピペット: 「決まった体積(例:10ml)」を正確に測り取るストローのような器具。
- メスフラスコ: 正確な濃度の溶液を作るときに使う、底が平らなフラスコ。
- ビュレット: 目盛りがついていて、下のコックをひねると液を滴下できる細長い管。垂らした量を正確に読み取ります。
- コニカルビーカー: 下で反応させるための三角フラスコのような容器。振っても液が飛び散りにくい形をしています。
3. 「滴定曲線」と指示薬の選び方(最重要)
塩基を少しずつ加えていくと、pHはどう変化するのか? それをグラフにしたのが**「滴定曲線(てきていきょくせん)」です。
すべてのグラフに共通するのは、中和点付近でpHがエレベーターのように急上昇する(pH飛躍)**ことです。
この「急上昇(ジャンプ)」の場所によって、使える指示薬(MOかPPか)が決まります。
パターン①:強酸 ($HCl$) × 強塩基 ($NaOH$)
- スタート: pH 1(強い酸)
- ジャンプ: pH 3 〜 10 くらいまで一気に上がる。
- 中和点: pH 7 (ど真ん中)
- 使える指示薬:
- メチルオレンジ (MO):変色域(3.1〜4.4)を通過する $\rightarrow$ ○使える
- フェノールフタレイン (PP):変色域(8.0〜9.8)を通過する $\rightarrow$ ○使える
- 結論: どっちでもOK!
パターン②:弱酸 ($CH_3COOH$) × 強塩基 ($NaOH$)
お酢を劇薬で中和するイメージです。
- スタート: pH 3くらい(弱い酸なので最初から少し高い)。
- ジャンプ: pH 7 〜 10 くらいの高い位置でジャンプする。
- 中和点: pH 7より大きい(塩基性になる)
- ※弱酸由来の塩が水と反応して塩基性を示すためです。
- 使える指示薬:
- MO(3.1〜4.4):ジャンプの手前で変色してしまう $\rightarrow$ ×使えない
- PP(8.0〜9.8):ジャンプの範囲に入っている $\rightarrow$ ○使える!
- 結論: フェノールフタレイン (PP) を使う!
パターン③:強酸 ($HCl$) × 弱塩基 ($NH_3$)
強い酸を、弱い塩基で中和します。
- ゴール: 弱い塩基なので、pH 14までは上がらず、11くらいで止まる。
- ジャンプ: pH 3 〜 7 くらいの低い位置でジャンプする。
- 中和点: pH 7より小さい(酸性になる)
- 使える指示薬:
- MO(3.1〜4.4):ジャンプの範囲に入っている $\rightarrow$ ○使える!
- PP(8.0〜9.8):ジャンプの後で変色してしまう $\rightarrow$ ×使えない
- 結論: メチルオレンジ (MO) を使う!
覚え方のコツ(指示薬選び)
- 「強いもの同士」はなんでもOK。
- 「弱いもの」が混ざると、中和点は**「強い方」に引っ張られる。**
- 相手が強塩基なら、中和点はアルカリ側 $\rightarrow$ アルカリで色が変わる PP を使う。
- 相手が強酸なら、中和点は酸性側 $\rightarrow$ 酸性で色が変わる MO を使う。
パターン④:弱酸 × 弱塩基(p.173)
ジャンプがほとんど起きず、ダラダラとpHが上がるため、中和点がわかりません。
したがって、滴定には向きません(指示薬も使えません)。
4. 全体のまとめ
この教科書(化学IB 第3編)の範囲を一通り解説しました。
ポイントを振り返ります。
- 熱化学:
- 発熱は「+」、吸熱は「ー」。
- ヘスの法則で、式を足し算・引き算して熱量を求める。
- 酸と塩基:
- 酸は $H^+$、塩基は $OH^-$。
- 強酸・強塩基(ほぼ100%電離)の種類を暗記する。
- $\text{pH} = -\log[H^+]$。水なら $[H^+] \times [OH^-] = 10^{-14}$。
- 中和滴定:
- 計算公式:$acv = bc'v'$ (酸のモル = 塩基のモル)。
- 滴定曲線:中和点の位置(pH 7より上か下か)で指示薬を選ぶ。
- 強塩基を使うなら フェノールフタレイン。
- 強酸を使うなら メチルオレンジ。
これで、ご提示いただいた画像の範囲の解説はすべて完了です。
もし、特定の計算問題の解き方が知りたい、あるいはもっと先の単元(酸化還元など)に進みたいなどのご要望があれば、いつでもお知らせください!
「塩(えん)」の正体と3つの分類
1. そもそも「塩(えん)」ってなに?
料理に使う「食塩(塩化ナトリウム)」だけが塩ではありません。化学の世界では、「酸の陰イオン」と「塩基の陽イオン」がくっついた物質をすべて「塩」と呼びます。
- 酸 ($HCl$) の $Cl^-$
- 塩基 ($NaOH$) の $Na^+$
- $\rightarrow$ 合体して $NaCl$ (塩) ができる。
つまり、中和反応で「水」と一緒に生まれる物質は、すべて「塩」です。
塩を作るいろいろな方法
一番有名なのは「酸+塩基」ですが、他にも塩ができる反応はあります。
特に重要なのが**「揮発性(きはつせい)の酸の遊離」**という反応です(p.175 ⑬)。
- 反応: 「揮発しやすい酸の塩」+「不揮発性の酸(硫酸)」 $\rightarrow$ 「揮発しやすい酸」が追い出される。
- 例: $NaCl$(固) $+ H_2SO_4$(濃) $\rightarrow NaHSO_4 + HCl$(気体として出る)
- イメージ:濃硫酸という「どっしり構えた強い酸」が来ると、塩酸のような「蒸発しやすい酸」は居場所を追われて出ていく、という感じです。
2. 塩の「3つの分類」(超重要!)
ここが最大のひっかけポイントです。
塩は、その**「形(化学式)」**によって3種類に分けられます。
「水に溶けたときの性質(酸性・アルカリ性)」ではないことに注意してください!
| 分類名 | 定義(化学式の見た目) | 具体例 | 注意点 |
| 正塩(せいえん) | $H^+$ も $OH^-$ も残っていない塩 | $NaCl$, $Na_2SO_4$, $CH_3COONa$ | 「中性塩」とも言いますが、水溶液が中性とは限りません! |
| 酸性塩 | 酸の $H$ が残っている塩 | $Na\mathbf{H}CO_3$, $Na\mathbf{H}SO_4$ | 形の中に $H$ があるから「酸性塩」。液性はアルカリ性の場合もあります。 |
| 塩基性塩 | 塩基の $OH$ が残っている塩 | $Cu\mathbf{(OH)}Cl$, $MgCl\mathbf{(OH)}$ | 形の中に $OH$ があるから「塩基性塩」。 |
初心者のための見分け方:
化学式を見て、真ん中に H が挟まっていたら「酸性塩」、OH が挟まっていたら「塩基性塩」、何もなければ「正塩」です。
3. 塩の名前のつけ方
基本は「陰イオンの名前」+「陽イオンの名前」の順で呼びます(化学式とは逆順)。
- $NaCl$: 塩化物イオン ($Cl^-$) + ナトリウム ($Na^+$) $\rightarrow$ 塩化ナトリウム
$NaHSO_4$: 硫酸水素イオン ($HSO_4^-$) + ナトリウム ($Na^+$) $\rightarrow$ 硫酸水素ナトリウム
塩を溶かすと何性?(塩の加水分解)
1. 結論:液性の見分け方(勝ち負けのルール)
まず、理屈の前に「結果」を覚えましょう。
その塩が「どんな酸」と「どんな塩基」から生まれたか(親は誰か)を考えます。ルールは**「強い方の性質が現れる」**です。
| 親の組み合わせ | 液性 | 理由(イメージ) |
| 強酸 + 強塩基 | 中性 | 両方強いので引き分け。 |
| 強酸 + 弱塩基 | 酸性 | 酸が勝つので酸性になる。 |
| 弱酸 + 強塩基 | 塩基性 | 塩基が勝つので塩基性になる。 |
| 弱酸 + 弱塩基 | (場合による) | ※高校化学ではあまり出ません。 |
- 例:塩化アンモニウム ($NH_4Cl$)
- 親:塩酸(強酸)+ アンモニア(弱塩基)
- 判定:酸の勝ち $\rightarrow$ 酸性
- 例:酢酸ナトリウム ($CH_3COONa$)
- 親:酢酸(弱酸)+ 水酸化ナトリウム(強塩基)
- 判定:塩基の勝ち $\rightarrow$ 塩基性
2. 理由:なぜそうなる?(加水分解のメカニズム)
なぜ「弱い方の親」を持つイオンは、水と反応してしまうのでしょうか?
それは、**「弱酸(や弱塩基)は、イオンの状態でいるのが苦手だから」**です。
① 酢酸ナトリウム(塩基性になる理由)
$CH_3COONa$ を水に溶かすと、$CH_3COO^-$(酢酸イオン)と $Na^+$ に分かれます。
- $Na^+$: 強塩基出身。イオンのままで平気(単独行動OK)。
- $CH_3COO^-$: 弱酸出身。イオンでいるより、元の分子 ($CH_3COOH$) に戻りたい(寂しがり屋)。
そこで、$CH_3COO^-$ は水分子 ($H_2O$) から無理やり $H^+$ を奪って元の姿に戻ろうとします。
$$CH_3COO^- + H_2O \rightleftharpoons CH_3COOH + \mathbf{OH^-}$$
結果として、水中に $OH^-$(アルカリ性の元)が余ってしまうため、塩基性になります。これを**「塩の加水分解」**といいます。
② 塩化アンモニウム(酸性になる理由)
$NH_4Cl$ を水に溶かすと、$NH_4^+$(アンモニウムイオン)と $Cl^-$ に分かれます。
- $Cl^-$: 強酸出身。イオンのままで平気。
- $NH_4^+$: 弱塩基出身。元の $NH_3$ に戻りたい。
$$NH_4^+ + H_2O \rightleftharpoons NH_3 + H_2O + \mathbf{H^+}$$
(正確には $NH_4^+ \rightleftharpoons NH_3 + H^+$)
結果として、水中に $H^+$(酸性の元)を出してしまうため、酸性になります。
3. 要注意!「酸性塩」の液性(例外あり)
「酸性塩($H$ が残っている塩)」は、必ず酸性になるわけではありません。ここがテストの狙い目です。
パターンA:重曹(炭酸水素ナトリウム $NaHCO_3$)
- 分類:酸性塩($H$があるから)
- 液性:塩基性(アルカリ性)
- 理由:残っている $H$ を出す力よりも、水から $H$ を奪う力(加水分解)の方が強いため、$OH^-$ を出して塩基性になります。「ベーキングパウダー」として使われる通り、弱アルカリ性です。
パターンB:硫酸水素ナトリウム ($NaHSO_4$)
- 分類:酸性塩
- 液性:酸性
- 理由:硫酸は「超」強酸なので、残っている $H$ を「まだ出せるぞ!」とばかりに放出します(電離)。
$$HSO_4^- \rightarrow H^+ + SO_4^{2-}$$
ガンガン $H^+$ を出すため、酸性になります。
全体のまとめ(第2章の修了)
この章で学んだ「塩の性質」のポイントは以下の通りです。
- 塩の定義: 酸の陰イオンと塩基の陽イオンが結合したもの。
- 3つの分類: 化学式に $H$ があれば「酸性塩」、$OH$ があれば「塩基性塩」、なければ「正塩」。
- 液性のルール: 「強い親の性質」が現れる(強酸+弱塩基=酸性)。
- 加水分解: 弱い親を持つイオンが、水と反応して元の姿に戻ろうとする現象。
これで「酸と塩基」の大きな山場は越えました。
この知識があれば、入試問題の「pHの並び替え問題」や「物質の推定問題」も解けるようになります。
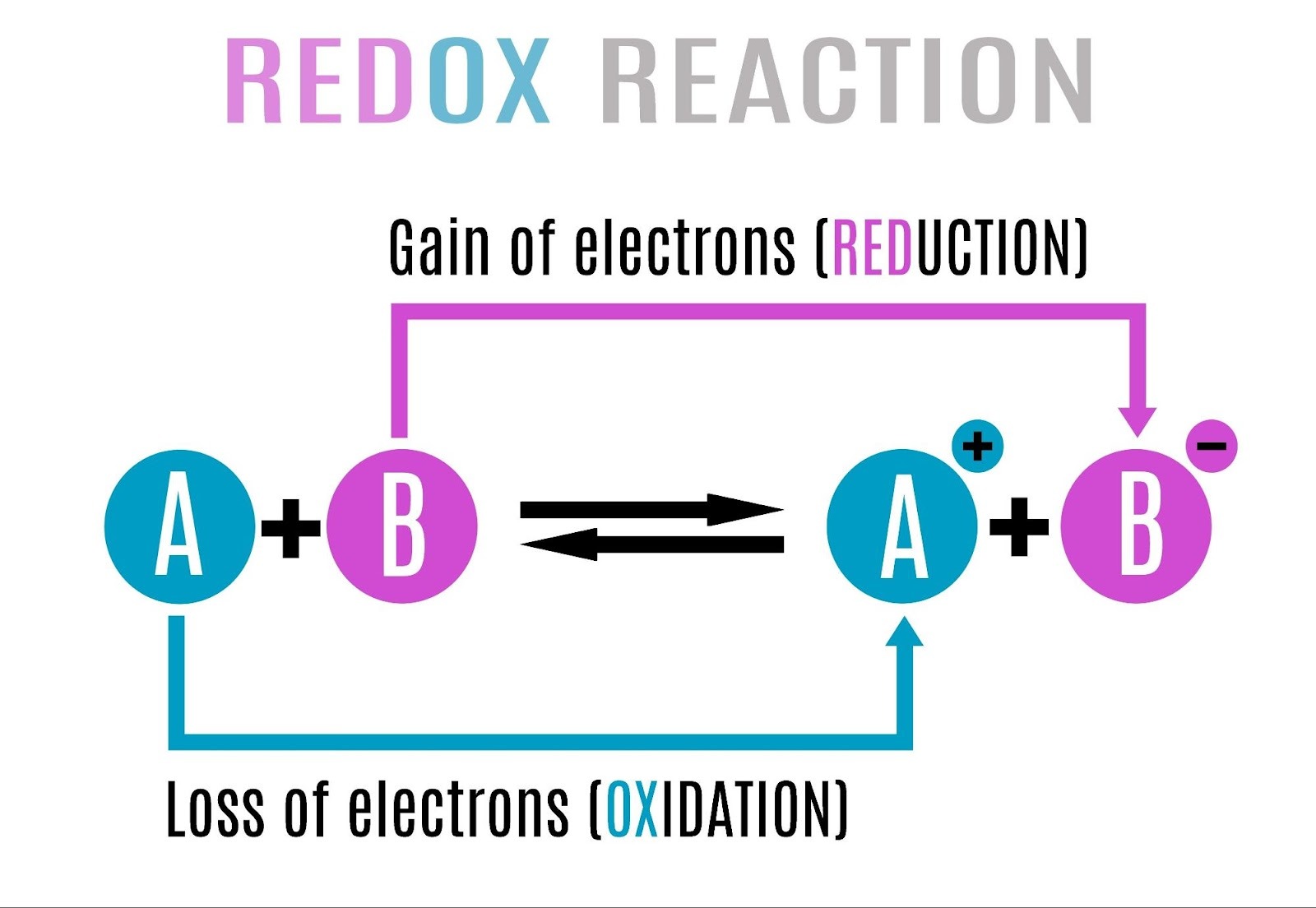
酸化数(さんかすう)の計算ルール
(教科書 p.186〜188 解説)
1. 酸化数ってなに?
(教科書 p.186)
「電子($e^-$)をどれだけ得したか、損したか」を表す数値です。
- プラス (+): 電子を失って(損して)、プラスに傾いている状態。
- マイナス (-): 電子をもらって(得して)、マイナスに傾いている状態。
- ゼロ (0): 貸し借りなしの状態。
2. 計算のための「4つの鉄則」
(教科書 p.186〜187)
パズルのルールだと思って、この4つだけ覚えてください。優先順位の高い順です。
ルール①:独りぼっちは「0」 (単体)
他の元素とくっついていない原子(単体)は、電子の貸し借りがないので必ず 0 です。
- 例:$H_2$, $O_2$, $Cu$, $Fe$ $\rightarrow$ すべて酸化数は 0。
ルール②:単純なイオンは「イオンの価数」 (単原子イオン)
イオンの右上の数字がそのまま酸化数になります。
- 例:$Na^+$ $\rightarrow$ +1
- 例:$S^{2-}$ $\rightarrow$ -2
ルール③:化合物中の $H$ は「+1」、$O$ は「-2」
(教科書 p.186)
他の原子とくっついている時(化合物)は、基本的にこの値を使います。
- 水素 ($H$): +1
- 酸素 ($O$): -2
- (※例外:過酸化水素 $H_2O_2$ の $O$ は -1 ですが、まずは基本を覚えましょう)
ルール④:合計は「0」または「イオンの電荷」
(教科書 p.187)
- 化合物全体: 中身の酸化数を全部足すと 0 になる。
- 多原子イオン: 中身の全部足すと イオンの電荷 になる(例:$SO_4^{2-}$ なら合計 -2)。
3. 実践!酸化数の計算(方程式を立てる)
(教科書 p.187 例題)
ルールを使って、分からない原子($x$)の酸化数を計算してみましょう。
【例題】 硫酸 ($H_2SO_4$) の中の硫黄 ($S$) の酸化数は?
- 分かっていること:
- $H$ は $+1$ (ルール③)
- $O$ は $-2$ (ルール③)
- 全体の合計は $0$ (ルール④)
- 式を立てる:
$$(\text{Hが2個}) + (\text{Sが1個}) + (\text{Oが4個}) = 0$$
$$(+1 \times 2) + x + (-2 \times 4) = 0$$ - 計算する:
$$2 + x - 8 = 0$$
$$x - 6 = 0$$
$$x = +6$$
答え:+6
このように、簡単な一次方程式で求められます。
4. 酸化・還元の判定(増えたか減ったか?)
(教科書 p.187〜188)
酸化数がわかれば、反応の前後で数字を比べるだけで判定できます。
- 酸化された: 酸化数が増えた(電子を失ってプラスが増した)。
- 例:$0 \rightarrow +2$
- 還元された: 酸化数が減った(電子をもらってマイナス寄りになった)。
- 例:$+2 \rightarrow 0$
判定の例:銅の精錬
(教科書 p.187 図30)
$$CuO + H_2 \rightarrow Cu + H_2O$$
- 銅 ($Cu$):
- 左辺($CuO$): $O$が$-2$なので、$Cu$は **$+2$**
- 右辺($Cu$): 単体なので $0$
- 変化: $+2 \rightarrow 0$ (減った) $\rightarrow$ 還元された
- 水素 ($H$):
- 左辺($H_2$): 単体なので $0$
- 右辺($H_2O$): 化合物なので $+1$
- 変化: $0 \rightarrow +1$ (増えた) $\rightarrow$ 酸化された
 Shutterstock
Shutterstock
5. 酸化還元ではない反応もある
(教科書 p.188 例題(2))
すべての反応が酸化還元ではありません。例えば、前章でやった「中和反応」などは、酸化数が変化しません。
- 例:$CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2$
- $Ca$: $+2 \rightarrow +2$ (変化なし)
- $C$: $+4 \rightarrow +4$ (変化なし)
- $O$: $-2 \rightarrow -2$ (変化なし)
- $\rightarrow$ 酸化還元反応ではない!
第3章「酸化還元」前半まとめ
(教科書 p.188 まとめ表)
最後に、定義と酸化数の関係をまとめた最強の表を確認しましょう。
| 酸化 (Oxidation) | 還元 (Reduction) | |
| 酸素 $O$ | 結合する | 離れる |
| 水素 $H$ | 離れる | 結合する |
| 電子 $e^-$ | 放出する(失う) | 受け取る |
| 酸化数 | 増加する ($\nearrow$) | 減少する ($\searrow$) |
この表と「4つの計算ルール」さえあれば、どんな複雑な反応式でも怖くありません。
酸化剤と還元剤の正体
(教科書 p.189〜191 解説)
1. 「酸化剤」と「還元剤」ってなに?
(教科書 p.189)
言葉の響きに騙されないようにしましょう。ここが最大のつまずきポイントです。
- 酸化剤(San-ka-zai):
- 相手を酸化させる物質です(相手から電子を奪い取る悪役)。
- 自分自身は、電子を受け取って還元されます。
- 還元剤(Kan-gen-zai):
- 相手を還元させる物質です(相手に電子を押し付ける、あるいは恵む善人)。
- 自分自身は、電子を放出して酸化されます。
覚え方のコツ:
「旅行代理店」は「(自分ではなく)お客さんを旅行させる人」ですよね?
同じように「酸化剤」は「(自分ではなく)相手を酸化させるヤツ」と覚えましょう。
2. スター選手名鑑(必ず覚えるべき物質)
(教科書 p.190 表6)
誰が酸化剤で、誰が還元剤なのか? 教科書 p.190 の表は宝の地図です。特に以下の「代表選手」は、どう変化するか(半反応式)を書けるようにしておく必要があります。
代表的な酸化剤(電子を欲しがる)
- 過マンガン酸カリウム ($MnO_4^-$):
- 最強クラスの酸化剤。赤紫色をしています。酸性溶液中では $Mn^{2+}$(無色)になります。
- 二クロム酸カリウム ($Cr_2O_7^{2-}$):
- 赤橙色。反応すると $Cr^{3+}$(緑色)になります。
- ハロゲン ($Cl_2, Br_2, I_2$):
- 電子を奪って陰イオンになりたがります。
代表的な還元剤(電子をあげたい)
- シュウ酸 ($H_2C_2O_4$):
- 滴定でよく使われる標準的な還元剤。$CO_2$ になります。
- 硫化水素 ($H_2S$):
- 温泉の匂い。硫黄 ($S$) になります。
- 金属 ($Na, Mg$ など):
- 電子を捨てて陽イオンになりたがります。
3. どっちにもなれる「コウモリ」のような物質
(教科書 p.191)
「私は酸化剤!」「僕は還元剤!」と決まっている物質が多い中で、相手によって態度を変える物質が2つだけあります。これがテストによく出ます。
① 過酸化水素 ($H_2O_2$)
- 基本: 酸化剤として働きます(オキシドールとして消毒殺菌に使うのは、菌を酸化して殺すからです)。
- 例外: 相手が自分より強い酸化剤($KMnO_4$など)の時だけ、負けて還元剤になります。
- 式:$H_2O_2 \rightarrow O_2 + 2H^+ + 2e^-$
② 二酸化硫黄 ($SO_2$)
- 基本: 還元剤として働きます。
- 例外: 相手が $H_2S$(もっと強い還元剤)の時だけ、酸化剤になります。
- 反応:$SO_2 + 2H_2S \rightarrow 3S + 2H_2O$
【後半】複雑な反応式の作り方と滴定
(教科書 p.192〜193 解説)
酸化還元の化学反応式は、係数が複雑で、暗記するのは不可能です。
しかし、**「3ステップの組み立て方」**さえ知っていれば、その場で作れます。
1. 酸化還元反応式の作り方(3ステップ法)
(教科書 p.192 例題)
例として、「過マンガン酸カリウム(酸化剤)」と「過酸化水素(還元剤)」の反応式を作ってみましょう。
ステップ①:半反応式($e^-$ の式)を並べる
p.190の表を見て、電子を含む式を書きます。
- 酸化剤: $MnO_4^- + 8H^+ + 5e^- \rightarrow Mn^{2+} + 4H_2O$ ...①
- 還元剤: $H_2O_2 \rightarrow O_2 + 2H^+ + 2e^-$ ...②
ステップ②:電子 $e^-$ の数を合わせて消す
①式は電子5個、②式は電子2個です。最小公倍数の「10」に合わせて足し算します。
- ①式を $\times 2$ (電子10個受け取る)
- ②式を $\times 5$ (電子10個放出する)
$$2MnO_4^- + 16H^+ + 10e^- \rightarrow 2Mn^{2+} + 8H_2O$$
$$+) \quad 5H_2O_2 \rightarrow 5O_2 + 10H^+ + 10e^-$$
$$2MnO_4^- + 6H^+ + 5H_2O_2 \rightarrow 2Mn^{2+} + 8H_2O + 5O_2$$
...(イオン反応式)
※左辺の $16H^+$ と右辺の $10H^+$ を打ち消して、左辺に $6H^+$ が残りました。
ステップ③:省略されていたイオンを戻す
反応液には、省略されていた「観客イオン」がいます。
- $MnO_4^-$ は $KMnO_4$ 由来なので、$K^+$ を2個足す。
- $H^+$ は硫酸 ($H_2SO_4$) 由来なので、$SO_4^{2-}$ を3個足す。
両辺に足して整理すると、完成です!
$$2KMnO_4 + 3H_2SO_4 + 5H_2O_2 \rightarrow 2MnSO_4 + K_2SO_4 + 8H_2O + 5O_2$$
2. 酸化還元滴定(実験で濃度を測る)
(教科書 p.193)
中和滴定と同じように、酸化還元反応を使って濃度を調べる実験です。
最も有名なのが**「過マンガン酸カリウム滴定」**です。
実験の特徴
- 指示薬がいらない!
- 過マンガン酸カリウム ($KMnO_4$) は鮮やかな赤紫色ですが、反応後の $Mn^{2+}$ は無色です。
- 滴下して、色が消えずに**「うすい赤紫色」が残った瞬間**が終点です。
計算の公式(中和と同じ!)
(教科書 p.193 ポイント)
$$(\text{酸化剤のモル}) \times (\text{受け取る} e^- \text{の数}) = (\text{還元剤のモル}) \times (\text{出す} e^- \text{の数})$$
詳しく書くと:
$$C_1 \times V_1 \times (\text{価数}) = C_2 \times V_2 \times (\text{価数})$$
- ここでの「価数」とは、1molあたりやり取りする電子の数です。
- $KMnO_4$ なら電子 5個 ($5e^-$) なので「5価」。
- $H_2O_2$ なら電子 2個 ($2e^-$) なので「2価」。
計算自体は、中和滴定のときと全く同じ感覚で解くことができます。
全体のまとめ
この章(酸化還元)の重要ポイントは以下の通りです。
- 定義: 「電子を失う=酸化」「電子を得る=還元」。
- 酸化数: ルールに従って計算し、増減で判定する。
- 役割: 「酸化剤(自分は還元される)」と「還元剤(自分は酸化される)」。
- 式の作成: 半反応式の電子の数をそろえて合体させる。
- 計算: (モル $\times$ 電子数) がイコールになる。
これで酸化還元の分野は一通り完了です!
金属の格付けランキング(イオン化傾向)
(教科書 p.195〜198 解説)
1. イオン化傾向ってなに?
(教科書 p.195)
金属が水溶液中で、電子($e^-$)を捨てて陽イオンになろうとする性質の強さのことです。
いわば、金属たちの**「イオンへのなりたがり度ランキング」**です。
- イオン化傾向が大きい: すぐに電子を捨てて溶け出す(さびやすい、反応しやすい)。
- 例:ナトリウム、マグネシウムなど。
- イオン化傾向が小さい: 電子をしっかり持っていて、溶けにくい(さびにくい、安定している)。
- 例:金、プラチナなど。
実験:銅と銀の力関係
硝酸銀水溶液($Ag^+$がいる)に、銅線($Cu$)を入れると、銅線の表面に銀($Ag$)が樹木のように析出します(銀樹)。
これは、**「銅の方が銀よりもイオンになりたがっている」**からです。
- 式: $Cu + 2Ag^+ \rightarrow Cu^{2+} + 2Ag$
- 銅($Cu$):電子を捨ててイオン($Cu^{2+}$)になって溶け出した(酸化された)。
- 銀イオン($Ag^+$):押し付けられた電子を受け取って単体($Ag$)に戻った(還元された)。
結論: イオン化傾向は $Cu > Ag$ です。
2. 金属のイオン化列(この順番は絶対暗記!)
(教科書 p.196)
いろいろな金属を「なりたがり順」に並べたものを「イオン化列」といいます。
教科書にある語呂合わせなどで、必ず順番を覚えましょう。
【イオン化列】
$$K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H_2) > Cu > Hg > Ag > Pt > Au$$
- 左側 ($K, Ca, Na...$): イオン化傾向が大。反応性が高く、すぐに酸化される(還元剤として働く)。
- 右側 ($Pt, Au...$): イオン化傾向が小。反応しにくく、いつまでもピカピカ(貴金属)。
- 真ん中の $(H_2)$: 基準として水素が入っています。これより左の金属は、酸に溶けて水素を発生します。
3. 「何と反応するか?」のルール表
(教科書 p.197〜198,)
このランキングによって、「水」や「酸」に対する態度がガラリと変わります。ここがテストの最頻出ポイントです。
① 水との反応(どこまで溶ける?)
イオン化傾向が大きいほど、冷たい水でも激しく反応します。
- $K, Ca, Na$ (超元気): 常温の水と激しく反応して水素を出す。
- $Mg$: 熱水となら反応する。
- $Al, Zn, Fe$: 高温の水蒸気となら反応する(酸化物を生じる)。
- それ以下: 水とは反応しない。
② 酸との反応(水素が出るか?)
- $Pb$ までの金属 ($K \sim Pb$): 塩酸や希硫酸などの普通の酸に溶けて、水素 ($H_2$) を発生します。
- 理由:水素($H$)よりもイオン化傾向が大きいので、$H^+$ を追い出して自分が座るからです。
- 式:$Zn + 2HCl \rightarrow ZnCl_2 + H_2$
- $Cu$ 以下の金属 ($Cu, Hg, Ag$): 普通の酸には溶けません(水素に負けているから)。
- 例外: 「酸化力の強い酸」(硝酸や熱濃硫酸)には溶けます。ただし、出るのは水素ではなく、$NO$ や $SO_2$ などのガスです。
- $Pt, Au$ (最強の金属): どんな酸にも溶けません。
- 例外: 王水(おうすい)(濃塩酸と濃硝酸を $3:1$ で混ぜた液)には溶けます。
③ 特別な例外:不動態(ふどうたい)
(教科書 p.198 表7)
$Al$ (アルミニウム), $Fe$ (鉄), $Ni$ (ニッケル) の3人は、濃硝酸に入れると溶けません。
- 理由: 表面に緻密な酸化膜(バリア)が一瞬で作られ、中を守ってしまうからです。この状態を「不動態」といいます。
- ※「手($Fe$)に($Ni$)ある($Al$)不動態」と覚えたりします。
ここまでは「金属の強さランキング」の話でした。
電池の仕組みと種類
(教科書 p.199〜204 解説)
1. 電池の基本ルール(ここだけ覚えよう!)
(教科書 p.200 ポイント)
どんな複雑な電池でも、以下のルールは共通です。
- 負極(ふきょく / マイナス極): イオン化傾向が大きい方の金属。
- 電子($e^-$)を放出して溶け出す(酸化反応)。「電子の供給源」です。
- 正極(せいきょく / プラス極): イオン化傾向が小さい方の金属。
- やってきた電子($e^-$)を受け取る場所(還元反応)。
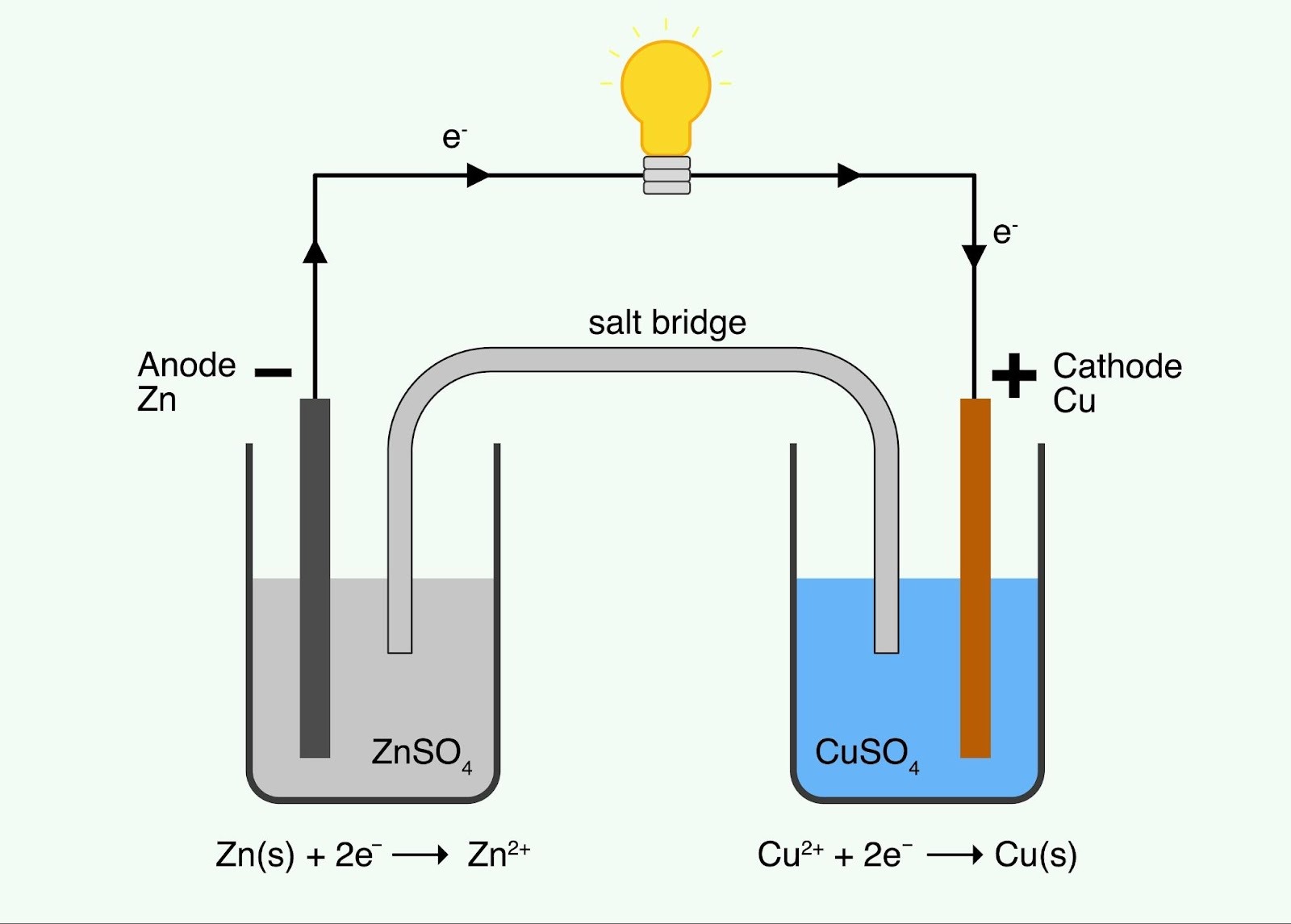
2. 世界初の電池「ボルタ電池」
(教科書 p.199, p.200)
イタリアのボルタが発明した、最もシンプルな電池です。
- 材料: 亜鉛板($Zn$)、銅板($Cu$)、希硫酸($H_2SO_4$)
- 仕組み:
- 負極 ($Zn$): $Zn$ はイオン化傾向が大きいので、電子を捨てて溶けます。
$$Zn \rightarrow Zn^{2+} + 2e^-$$ - 正極 ($Cu$): 電子は導線を通って $Cu$ 側に移動します。しかし、$Cu$ 自身は変化しません。代わりに、水溶液中の $H^+$ が電子を受け取ります。
$$2H^+ + 2e^- \rightarrow H_2$$
(銅板の表面から水素の泡が出ます) - 弱点(分極):
発生した水素の泡が銅板を包んでしまい、すぐに電気が流れなくなります。これを**「分極(ぶんきょく)」**といいます。 - ※酸化剤(過酸化水素など)を加えると、水素を水に変えて復活します。これを「減極剤(げんきょくざい)」といいます。
 Shutterstock
Shutterstock
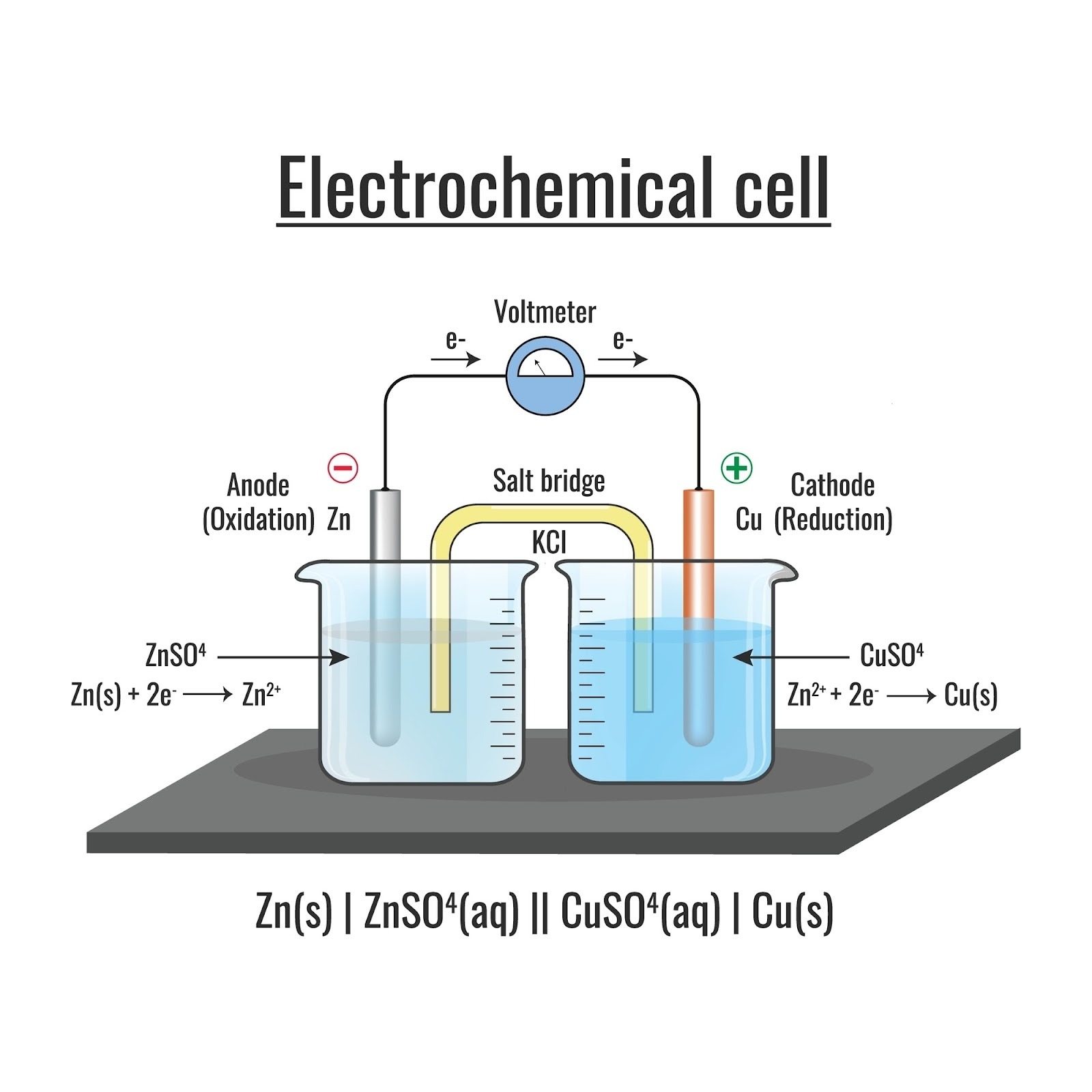
3. 進化した「ダニエル電池」
(教科書 p.201)
ボルタ電池の弱点(泡が出る)を克服した電池です。
ポイントは、**「素焼きの容器(しきり)」**を使って、2種類の液を分けたことです。
- 構造:
- 負極側:亜鉛板 + 硫酸亜鉛水溶液 ($ZnSO_4$)
- 正極側:銅板 + 硫酸銅(II)水溶液 ($CuSO_4$)
- 真ん中:素焼き板(イオンだけを通す壁)で仕切る。
- 反応:
- 負極 ($Zn$): やはり $Zn$ が溶けます。
$$Zn \rightarrow Zn^{2+} + 2e^-$$ - 正極 ($Cu$): やってきた電子を、液中の銅イオン($Cu^{2+}$)が受け取ります。
$$Cu^{2+} + 2e^- \rightarrow Cu$$
(銅板の上に、さらに銅がメッキされるように析出します) - 長所: ガス(水素)が出ないので、電圧が安定して長持ちします。
 Shutterstock
Shutterstock
4. 身近な実用電池①:マンガン乾電池
(教科書 p.202)
リモコンなどで使う普通の乾電池です。液こぼれしないように、電解液をペースト状にしています。
- 負極: ケースそのものが亜鉛 ($Zn$) でできている(使っているとケースが薄くなる)。
- 正極: 中心の炭素棒 ($C$)。
- 正極合剤: 二酸化マンガン ($MnO_2$)。これが水素の発生を抑える減極剤として働きます。
- ※充電はできません(一次電池)。
5. 身近な実用電池②:鉛蓄電池(なまりちくでんち)
(教科書 p.202, p.203)
車のバッテリーに使われる、重くてパワフルな電池です。充電して繰り返し使えます(二次電池)。
両方の極が「鉛」の仲間であることが特徴です。
- 負極: 鉛 ($Pb$) $\rightarrow$ イオン化傾向が大きいので溶ける。
- 正極: 酸化鉛(IV) ($PbO_2$)
- 電解液: 希硫酸 ($H_2SO_4$)
反応のポイント(放電するとどうなる?)
なんと、負極も正極も、反応すると**同じ物質(硫酸鉛 $PbSO_4$)**に変身します。
- 負極: $Pb + SO_4^{2-} \rightarrow PbSO_4 + 2e^-$
- 正極: $PbO_2 + 4H^+ + SO_4^{2-} + 2e^- \rightarrow PbSO_4 + 2H_2O$
- 結果:
- 両方の電極が白く ($PbSO_4$) なる。
- 水 ($H_2O$) が生まれるので、硫酸が薄くなる(濃度が下がる)。
充電(じゅうでん)
外部から逆向きに電気を流すと、反応が逆転して元の $Pb$ と $PbO_2$ に戻ります。硫酸の濃度も回復します。
全体のまとめ(第4章 電池)
(教科書 p.204 まとめ)
この章の要点は以下の通りです。
- イオン化傾向: $K > \dots > Al > Zn > Fe > \dots > Cu > Ag > Au$ の順を覚える。
- 電池の原理: イオン化傾向の大きい金属が負極になり、溶けて電子を出す。
- ボルタ電池: 負極は亜鉛、正極は銅。水素の泡で分極するのが欠点。
- ダニエル電池: 素焼き板で液を分け、泡が出ないように改良した。
- 鉛蓄電池: $Pb$ と $PbO_2$ が、硫酸中で反応して両方 $PbSO_4$ になる(充電可能)。
これで「電池」の範囲は完了です!
電気分解の仕組みと「優先順位」
(教科書 p.205〜208 解説)
1. 電気分解とは?
(教科書 p.205)
電解質の水溶液に電極を入れ、外部から電気エネルギー(電池など)をつないで、無理やり酸化還元反応を起こすことです。
- 電池との違い:
- 電池:化学エネルギー $\rightarrow$ 電気エネルギー
- 電気分解:電気エネルギー $\rightarrow$ 化学エネルギー
電極の名前と役割
電池の極とつながっているかで名前が決まります。
- 陰極(いんきょく): 電池の**負極(ー)**につなぐ方。
- 電子($e^-$)が流れ込んでくる場所。
- ここで電子を受け取る反応(還元)が起きます。
- 陽極(ようきょく): 電池の**正極(+)**につなぐ方。
- 電子($e^-$)が吸い上げられる場所。
- ここで電子を放出する反応(酸化)が起きます。
2. 【最重要】「誰が反応する?」の優先順位
(教科書 p.206)
水溶液の中には、いくつかのイオンや水分子が混在しています。その中で誰が代表して電子を受け取る(または放出する)のかには、厳格なルールがあります。
このルールさえ覚えれば、どんな問題も解けます。
① 陰極での反応(電子を受け取るのは誰?)
**「イオン化傾向(なりたがり度)」**で決まります。
水溶液中にいる陽イオンを見て判断します。
- イオン化傾向が小さい金属 ($Ag^+, Cu^{2+}$ など) がいる場合:
- 彼らが真っ先に電子を受け取って、単体の金属として析出します。
- 例:$Cu^{2+} + 2e^- \rightarrow Cu$
- イオン化傾向が大きい金属 ($Na^+, K^+, Al^{3+}$ など) しかいない場合:
- 彼らはイオンのままでいたいので、反応しません。
- 代わりに、溶媒の水 ($H_2O$) が電子を受け取って、水素 ($H_2$) が発生します。
- 式:$2H_2O + 2e^- \rightarrow H_2 + 2OH^-$ (水溶液は塩基性になる!)
② 陽極での反応(電子を出すのは誰?)
**「電極の材質」と「陰イオンの種類」**で決まります。
- 電極自体が金・白金・炭素以外 ($Cu, Ag$ など) の場合:
- 電極自身が溶けます(身を削って電子を出す)。
- 例:$Cu \rightarrow Cu^{2+} + 2e^-$
- 電極が $Pt$(白金)や $C$(炭素)の場合:
- 電極は反応しません。水溶液中の陰イオンを見ます。
- A. ハロゲン ($Cl^-, I^-$) がいる場合:
- ハロゲンが電子を出して単体になります。
- 例:$2Cl^- \rightarrow Cl_2 + 2e^-$ (塩素ガス発生)
- B. ハロゲン以外 ($SO_4^{2-}, NO_3^-$) の場合:
- これらは安定なので反応しません。
- 代わりに、溶媒の水 ($H_2O$) が電子を出して、酸素 ($O_2$) が発生します。
- 式:$2H_2O \rightarrow O_2 + 4H^+ + 4e^-$ (水溶液は酸性になる!)
3. 具体例で見てみよう
(教科書 p.206〜207)
ルールを使って、代表的なパターンの結果を予測してみましょう。
パターンA:塩化銅(II)水溶液 ($CuCl_2$) + 炭素電極
- 陰極: $Cu^{2+}$ がいる(イオン化傾向小さい) $\rightarrow$ 銅 ($Cu$) が析出。
- 陽極: $Cl^-$ がいる(ハロゲン) $\rightarrow$ 塩素 ($Cl_2$) が発生。
- 結果: 水溶液の色(青色)が薄くなる。
パターンB:塩化ナトリウム水溶液 ($NaCl$) + 炭素電極
- 陰極: $Na^+$ がいる(イオン化傾向大きい) $\rightarrow$ $Na$ は反応せず、水が反応して水素 ($H_2$) が出る。
- ※近くに $OH^-$ ができるので、フェノールフタレインを加えると赤くなる。
- 陽極: $Cl^-$ がいる(ハロゲン) $\rightarrow$ 塩素 ($Cl_2$) が発生。
- 結果: 残った液は $NaOH$(水酸化ナトリウム)水溶液になる。
パターンC:硫酸銅(II)水溶液 ($CuSO_4$) + 白金電極
- 陰極: $Cu^{2+}$ がいる $\rightarrow$ 銅 ($Cu$) が析出。
- 陽極: $SO_4^{2-}$ がいる(ハロゲンじゃない) $\rightarrow$ 水が反応して酸素 ($O_2$) が出る。
- 結果: 水中に $H^+$ が残るため、溶液は硫酸 ($H_2SO_4$) に変化していく(酸性になる)。
4. 電極を変えると結果が変わる?
(教科書 p.208)
同じ硫酸銅(II) ($CuSO_4$) 水溶液でも、陽極を白金($Pt$)から**銅($Cu$)**に変えると、反応が変わります。
- 陽極の反応:
- ルール通り、「電極が $Cu$」なので、電極自身が溶けます。
- $Cu \rightarrow Cu^{2+} + 2e^-$
- 結果: 陽極の銅板がどんどん痩せていき、溶液中の銅イオン濃度は変わりません(陰極で析出する分を、陽極が補充するため)。
- ※これが、後半で解説する「銅の電解精錬」の原理です。
電気分解の計算と応用
(教科書 p.209〜212 解説)
1. 電気分解の計算(ファラデーの法則)
(教科書 p.209, p.210)
化学反応式の主役は「モル(mol)」ですが、電気の世界の主役は「クーロン(C)」です。
この2つの世界をつなぐ**「通貨交換レート」**のようなものが、ファラデー定数です。
覚えるべき2つの公式
- 電気量(クーロン)の計算:
$$Q(\text{クーロン}) = i(\text{アンペア}) \times t(\text{秒})$$
- 注意: 時間は必ず**「秒 (second)」**に直して計算します。分や時間ではダメです。
- 電子のモルへの変換(ファラデー定数):
「電子 1mol の電気量は 96500 C である」
$$e^- (\text{mol}) = \frac{Q(\text{C})}{96500(\text{C/mol})}$$
- この 96500 という数字は、テストでは与えられますが、計算の要(かなめ)なので覚えておくと便利です。
計算の3ステップ(例題 p.210)
「2.0A の電流を 32分10秒 流して、硫酸銅(II)水溶液を電気分解したとき、析出する銅($Cu$)は何gか?」
- ステップ①:電気量(C)を出す
- 時間を秒に直す: $32分10秒 = (32 \times 60) + 10 = 1930 \text{秒}$
- $Q = 2.0(\text{A}) \times 1930(\text{s}) = 3860 \text{C}$
- ステップ②:電子($e^-$)は何molか?
- $3860 \div 96500 = 0.04 \text{mol}$
- これで「電子が 0.04mol 流れた」ことがわかりました。
- ステップ③:係数を見て物質量(mol)を出す
- 銅が析出する式:$Cu^{2+} + 2e^- \rightarrow Cu$
- 電子 2個 で、銅 1個 ができます($2:1$ の関係)。
- なので、銅のモル数は電子の半分です。
$0.04 \text{mol} \div 2 = 0.02 \text{mol}$ - 最後に質量(g)に直す:$0.02 \text{mol} \times 63.5(\text{原子量}) = 1.27 \text{g} \approx 1.3 \text{g}$
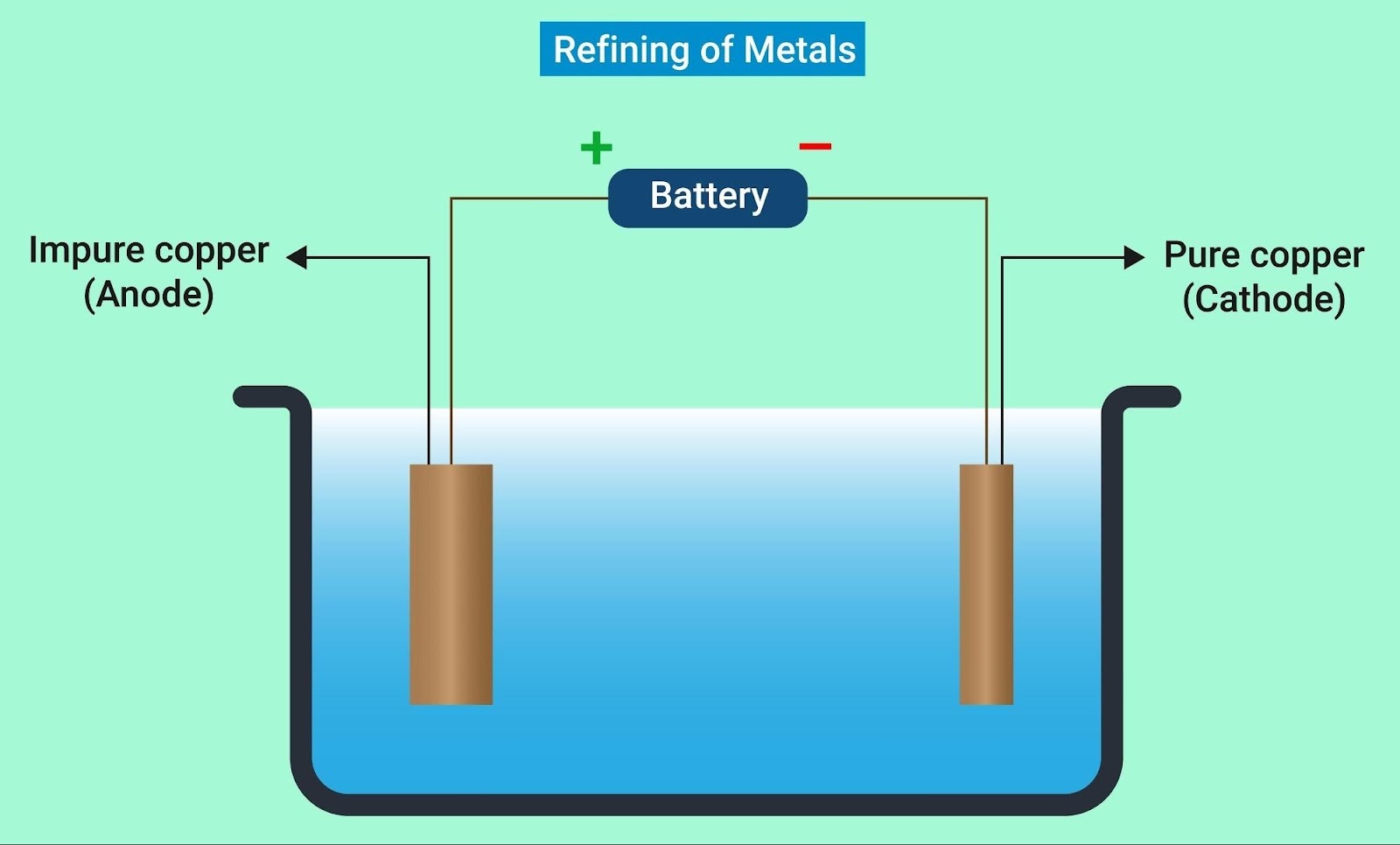
2. 工業への応用①:銅の電解精錬(純銅を作る)
(教科書 p.211)
不純物を含んだ銅(粗銅)から、純度99.99%以上のピカピカの銅(純銅)を作る技術です。
ここでも「イオン化傾向」が活躍します。
- 陽極(+): 粗銅(そどう)
- 不純物(亜鉛、鉄、金、銀など)が混じっています。
- 銅や、銅よりイオン化傾向が大きい金属($Zn, Fe$)は溶け出します。
- 重要: 金($Au$)や銀($Ag$)は溶けずに、そのままボロボロと下に落ちます。これを**「陽極泥(ようきょくでい)」**といい、貴金属の回収源になります。
- 陰極(ー): 純銅(じゅんどう)
- 溶け出したイオンのうち、銅($Cu^{2+}$)だけが析出して太っていきます($Zn$や$Fe$はイオンのまま液中に残る)。
 Shutterstock
Shutterstock
3. 工業への応用②:融解塩電解(アルミを作る)
(教科書 p.212)
アルミニウム($Al$)やナトリウム($Na$)のような「イオン化傾向が大きい金属」は、水溶液の電気分解では作れません(水が先に反応してしまうため)。
そこで、水を一滴も使わず、塩を直接ドロドロに溶かして(融解して)電気分解します。
アルミニウムの製錬
- 原料: アルミナ ($Al_2O_3$)
- 問題点: アルミナの融点は約2000℃と高く、溶かすのに莫大なエネルギーがかかります。
- 解決策: **「氷晶石(ひょうしょうせき)」**という魔法の粉を混ぜます。すると、約1000℃で溶けるようになり、電気分解が可能になります。
4. 工業への応用③:水酸化ナトリウムの製造
(教科書 p.211)
食塩水($NaCl$)を電気分解すると、以下の反応が起きます。
- 陽極: 塩素($Cl_2$)発生
- 陰極: 水素($H_2$)発生 + $NaOH$ 生成
このとき、できた塩素と$NaOH$が混ざると反応してしまうため、**「陽イオン交換膜」という特別なフィルターで仕切ります。この方法を「イオン交換膜法」**といいます。
全体のまとめ(第4章終了)
これで「電池と電気分解」の章は完了です。
- 電気分解の基本: 「誰が反応するか」の優先順位(イオン化傾向・ハロゲン・水)で決まる。
- 計算: $Q = i \times t$ と $96500$ を使って、電子のモル数を求めるのが全ての始まり。
- 応用: 銅の精錬(陽極泥)、アルミの製造(氷晶石)、$NaOH$の製造(イオン交換膜)は、名前と役割をセットで覚える。
非常に内容の濃い章でしたが、ここまで理解できれば高校化学の理論分野(物質の変化)の基礎はバッチリです。